2. 上海市疾病预防控制中心,上海 200336
2. Shanghai Center for Disease Control and Prevention, Shanghai 200336, China
自2019年12月,新型冠状病毒(2019 novel coronavirus,2019-nCoV)在中国肆虐,迅速蔓延的疫情严重威胁着人类的生命健康[1-2]。因此,对2019-nCoV的病原学、致病性及其防治的研究刻不容缓。
冠状病毒是一类有包膜的正链单链RNA病毒,基因组27~32 kb。冠状病毒在系统分类上属于套式病毒目(Nidovirales)、冠状病毒科(Coronaviridae)、正冠状病毒亚科(Orthocoronavirinae),正冠状病毒亚科又包含甲、乙、丙、丁4个属。自然界中,冠状病毒成员众多,宿主广泛,可感染多种禽类和哺乳动物。多数冠状病毒主要导致宿主消化道和呼吸道的感染,临床症状轻微或中等。仅有少数冠状病毒致病性强,可导致宿主产生严重反应甚至死亡[3]。已知的人类冠状病毒(human coronavirus, HCoV)有6种,甲型冠状病毒的HCoV-229E和HCoV-NL63及乙型冠状病毒属的HCoV-OC43和HCoV-HKU1主要引起普通感冒和症状较轻的呼吸系统感染,极少引起严重感染;但是,2003年出现的严重急性呼吸综合征冠状病毒(severe acute respiratory syndrome coronavirus, SARS-CoV)和2011年出现的中东呼吸综合征冠状病毒(Middle East respiratory syndrome coronavirus, MERS-CoV)均可引起致命的呼吸系统疾病[4]。2019-nCoV为第7种可感染人的冠状病毒,根据已发布的基因组信息,2019-nCoV属乙型冠状病毒的β亚群,与SARS-CoV全基因组序列同源性约为79.5%,与MERS-CoV基因组的同源性约为40%,与一种蝙蝠中的冠状病毒(bat CoV RaTG13)序列一致性高达96%[5]。其是否有动物中间宿主还有待研究。
有效的病毒细胞感染模型和动物感染模型,可为疫苗和药物的研发提供支持;也是体外深入认识2019-nCoV的感染特性和致病机制的关键,可为临床诊疗方案的制订和完善提供基础数据支撑。而这些模型的构建以及后续研究的开展均依赖感染性良好的病毒株。目前,国内仅少数几个实验室成功分离到能够稳定传代的2019-nCoV毒株,但毒株的感染效率和复制能力尚不理想[1, 5]。本研究通过优化2019-nCoV的分离、培养条件,从上海市确诊感染者的临床样本中成功分离到1株2019-nCoV,命名为nCoV-SH01。
1 材料与方法 1.1 材料临床样本:10份临床确诊的COVID-19患者鼻/咽拭子(1~10号标本),由上海市疾病预防控制中心提供,经实验室聚合酶链反应(polymerase chain reaction,PCR)重复检测,其中3、6、10号病毒核酸阳性。COVID-19康复期患者血清和健康人血清由本实验室保存。Vero E6细胞、Huh-7细胞株由本实验室保存。
1.2 方法 1.2.1 细胞培养Vero E6和Huh-7细胞培养采用含10%胎牛血清(Gibco公司)的高糖DMEM培养液(Hyclone公司),置5% CO2、37 ℃中培养。
1.2.2 病毒分离和培养操作在P3实验室中进行。将状态良好的Vero E6和Huh-7细胞分别接种于96孔细胞培养板,培养24 h后备用。
冻存的鼻/咽拭子标本放置于冰上升温而融化。弃96孔细胞培养板中培养液,每孔加入标本液25 μL;每个标本分别接种2类细胞系。另外,每个细胞系设2个对照孔,每孔仅加入25 μL维持液。将接种好的细胞培养板于5% CO2、37 ℃培养箱中孵育2 h。然后弃接种的标本液,每孔加入100 μL DMEM维持液〔(含胰酶16 μ g/mL,1%青、链霉素(Hyclone公司,Hyclone SV30010)〕, 放置5% CO2、37 ℃培养箱中继续培养,每日观察细胞病变。如有细胞病变,则在80%以上细胞单层被破坏时,收取细胞培养物。对没有出现的病变细胞,收取上清液,按类似方法盲传2代,并对细胞培养物进行实时荧光定量聚合酶链反应(real time fluorescence quantitative polymerase chain reaction,荧光定量RT-PCR)检测。
1.2.3 RNA提取及荧光定量RT-PCR检测使用300 μL Trizol LS(Invitrogen公司)充分裂解细胞培养物(100 μL)。加入80 μL氯仿,混匀静置室温10 min后,13 000 g离心15 min。取上清液250 μL,加入2 μL Glycoblue和250 μL异丙醇,混匀后13 000 g离心15 min;弃上清液,加入500 μL 75%乙醇,13 000 g离心5 min,洗涤蓝色沉淀;弃上清液,沉淀物于室温干燥5 min,加入10 μL RNA free水重悬。
取5 μL提取的RNA,采用双重荧光PCR检测样本或细胞培养物中的2019-nCoV核酸。具体操作按照“2019-nCoV(ORF1ab/N基因)核酸检测试剂盒”(上海伯杰公司,货号:SJ-HX-226-2)说明书进行。
1.2.4 病毒基因组测序及分析取5 μL RNA,利用反转录酶SSⅢ试剂盒(Invitrogen公司)进行cDNA合成,根据试剂盒说明书采用随机引物进行反转录反应,合成cDNA。送上海伯豪生物技术有限公司进行二代Illumina法测序。同时,设计合成20对引物,利用高保真酶SuperFi DNA Polymerase (Invitrogen公司)对分离毒株的基因序列进行PCR扩增。PCR体系:混合35 μL ddH2O、10 μL 5×PCR Buffer、1 μL dNTP (10 mmol/L)、1 μL Taq酶,加入特异性上、下游引物各1 μL(10 μ M)和1 μL cDNA。反应程序:94 ℃ 5 min;(94 ℃ 30 s、52 ℃ 90 s、72 ℃ 60 s,30个循环;72 ℃延伸5 min。产物用1%琼脂糖凝胶电泳检测。PCR产物胶回收后,送上海百力格生物技术有限公司进行一代Sanger法测序。测序后经拼接得到病毒的基因组全长序列并使用DNAStar7.1软件,将其与GenBank中已经发布的2019-nCoV序列进行比对分析。
1.2.5 免疫荧光实验经polylysine处理的玻片置于24孔板中,接种状态良好的Vero E6细胞,放置5% CO2、37 ℃培养箱中培养24 h;至玻片中细胞汇合度约80%时,将产生疑似细胞病变的第1代细胞培养上清液接种于玻片上培养的Vero E6细胞,置5% CO2、37 ℃中继续培养18 h。单层细胞用冷磷酸缓冲盐溶液(phosphate buffer saline,PBS)洗3遍,4%多聚甲醛(Sigma公司)室温固定30 min;PBS洗涤3遍,加入封闭缓冲液(含5% BSA和0.5% TX-100的PBS)封闭1 h;PBS洗涤3遍,加入由封闭缓冲液100倍稀释的COVID-19的康复者血清,室温孵育1 h,同时设健康人血清作为对照;用PBS洗涤3遍,再加入FITC标记的羊抗人荧光二抗(Thermo公司),室温孵育1 h;用PBS洗涤3遍;最后与4 ′, 6-二脒基-2-苯基吲哚(4 ′, 6-diamidino-2-phenylindole,DAPI)孵育10 min,PBS洗涤细胞玻片3遍。荧光显微镜(AMG公司)下观察结果。
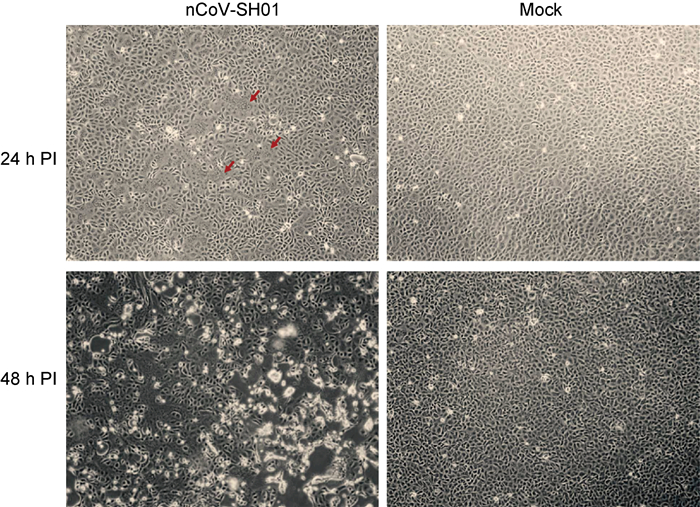
2 结果 2.1 细胞分离培养及细胞病变将10份鼻/咽拭子(SCDC-1~10)标本分别接种Vero E6和Huh-7细胞,24、48、72和96 h后观察细胞病变。结果显示,10号标本(SCDC-10)接种的Vero E6细胞48h后出现疑似合胞体的病变,至72 h,细胞几乎全部脱落、死亡。收获该样本的细胞培养物(下称SCDC-10-P1)。而其他标本接种的Vero E6和Huh-7细胞,连续4 d均未观察到有明显的细胞病变。
从收获的SCDC-10-P1提取RNA,进行RT-PCR检测及测序分析。同时,将细胞培养上清液继续接种于Vero E6细胞进行扩增。结果显示,在24 h后即可观察到明显的合胞体病变,48 h后细胞几乎全部脱落、死亡(图 1)。证明该标本中存在病毒,且其可在Vero E6细胞中快速复制。现将该病毒暂命名为nCoV-SH01。
|
| PI: post-infection 图 1 nCoV-SH01在Vero E6细胞上的细胞病变效应 Fig. 1 The cytopathic effects caused by nCoV-SH01 infection on Vero E6 |
其他标本即使未引起可疑的细胞病变,也于接种96 h后收集细胞,用TRIZOL裂解,用荧光定量RT-PCR检测2019-nCoV核酸;收获的细胞上清液,继续接种Vero E6和Huh-7细胞进行盲传。结果显示,连续盲传3 d仍未出现明显的细胞病变。荧光定量RT-PCR也未检测到病毒核酸。
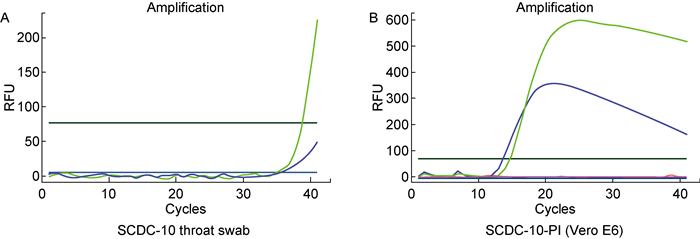
2.2 荧光定量RT-PCR检测到SCDC-10的循环阈值明显降低为确定2019-nCoV是否可在相应细胞中复制,利用“2019新型冠状病毒(ORF1ab/N基因)核酸检测试剂盒”对第1代和第2代细胞培养物进行检测和对比分析。结果显示,10号标本(SCDC-10)的荧光定量RT-PCR的循环阈(cycle threshold,CT)值为35.52,接近检测临界值。接种Vero E6细胞后,SCDC-10-P1荧光定量RT-PCR检测的CT值明显降低(图 2),提示细胞内2019-nCoV核酸量显著增加。除在SCDC-3接种的Huh-7细胞中可检出病毒核酸外,其他样本均未检测到(数据未显示)。SCDC-3检出的CT值明显高于其原始标本,提示病毒没有发生增殖,怀疑为接种后残留的RNA而非病毒复制所致。对所有10个样本盲传第2代所收获的Vero E6细胞和Huh7细胞培养物进行检测,结果显示,只有SCDC-10为阳性,其他样本全部为阴性(数据未显示)。说明,在SCDC-10接种的Vero E6和Huh-7细胞中均有2019-nCoV核酸复制。
|
| A: SCDC-10 throat swab. B:SCDC-10 Vero E6 cell culture. RFU: Relative fluorescence units. 图 2 SCDC-10咽拭子和第1次细胞培养上清液的2019-nCoV荧光定量RT-PCR检测 Fig. 2 2019-nCoV amplification curves of SCDC-10 sample and Vero E6 cell culture |
通过二代Illumina和一代Sanger法测序,分别获得了该分离毒株的全基因组序列,经比对分析,2种测序方法得到的序列完全一致。利用DNAStar7.1将该序列与GenBank已经公开的2019-nCoV毒株基因组全长序列进行比对分析,同源性>99.99%。测序结果显示,nCoV-SH01与最早分离的2019-nCoV Wuhan-Hu-1株高度同源。
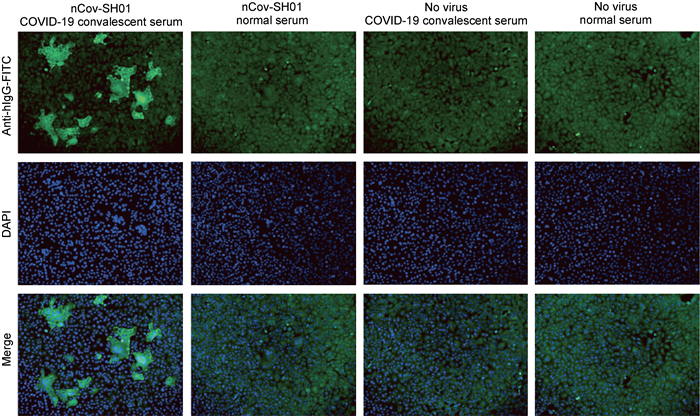
2.4 免疫荧光法检测结果为进一步确认SCDC-10-P1中有2019-nCoV复制及Vero E6细胞上的细胞病变与2019-nCoV感染相关,采用免疫荧光染色法,用1份来自COVID-19康复者的血清对SCDC-10感染的细胞进行检测,并设立了健康人血清对照和未感染病毒的正常细胞对照,以排除假阳性结果。结果显示,仅康复者的血清与SCDC-10的细胞呈阳性反应,且与细胞病变部位高度重合(图 3)。结果提示,SCDC-10接种后,细胞呈现的病变与2019-nCoV高度相关,细胞中存在2019-nCoV感染和相关病毒抗原的表达。
|
| 图 3 nCoV-SH01感染的Vero E6细胞中病毒抗原的检测 Fig. 3 Detection of viral antigens of nCoV-SH01 in Vero E6 cells |
上述致细胞病变效应、序列分析及免疫荧光检测所示结果充分证实已经成功分离并鉴定出1株2019-nCoV。鉴于该毒株为上海市成功分离的首个2019-nCoV毒株,因此将其正式命名为nCoV-SH01。该毒株在Vero E6细胞中复制迅速,可形成典型的合胞体病变,且病毒的滴度较高。序列分析发现nCoV-SH01毒株与早期分离的Wuhan-Hu-1株高度同源也说明病毒在传播过程中,其基因组相对稳定。
冠状病毒的分离比较困难,主要原因在于病毒与细胞受体结合并介导入侵的刺突蛋白(spike protein,S蛋白)比较大,且容易脱落或被破坏[6]。标本采集后,在保存、运输及冻融、离心等过程中,刺突(spike, S)蛋白易脱落,会降低病毒分离、培养的成功率[7]。某些冠状病毒尤其是乙型冠状病毒的S蛋白在入侵时需要被蛋白酶切割成S1和S2两个部分,因此,在分离、培养时适当使用胰酶处理可提高病毒的分离成功率[8]。胰酶可能促进了S蛋白的切割,使病毒更易在细胞间通过膜融合扩散,从而也更易形成合胞体[9-10]。另外,分离病毒所用的细胞系也非常关键,敏感细胞系和良好的细胞状态也是分离成功的关键。因此,在该病毒的分离、鉴定过程中,我们综合考虑了以上因素,选用了文献报道的敏感细胞系Vero E6和Huh-7细胞。对培养体系进行了优化,加入适量的胰酶,同时添加高效的抗生素以抑制可能的细菌和支原体污染,这可能是从低滴度标本中分离病毒的关键。结果在Vero E6细胞上成功分离到新型冠状病毒,且病毒可形成典型的合胞体病变。而在Huh-7细胞上虽然存在病毒核酸复制,但未观察到明显的细胞病变,也提示在不同细胞系上病毒的复制和对细胞的致病性具有差异。
有趣的是在临床标本中核酸的拷贝数高并不意味着病毒的分离率高。在1~10号鼻/咽拭子标本中,SCDC-3核酸拷贝数最高,CT值最小;而SCDC-10的CT值接近检测临界值,但却从10号样本中分离到病毒。推测采样时间、运输、保存条件等外界因素均可能影响病毒的易感性。提示在分离、培养条件相同的情况下,标本中是否存在具有感染性的病毒是影响分离成功的关键。
nCoV-SH01在Vero E6细胞中可形成典型的合胞体病变,且细胞病变进展迅速。荧光定量PCR结果提示,其可能具有较高的病毒滴度。nCoV-SH01株在感染后的18 h即可观察到明显的致细胞病变效应(cytopathic effect,CPE)和典型的合胞体病变,提示该毒株在Vero E6细胞上扩增性良好。而以往报道的分离株最早在72 h才能观察到病变[1, 5]。因此,该毒株扩增速度快,致细胞病变能力强。该细胞模型可用于病毒大量扩增和后续相关试验,如抗病毒药物筛选、中和抗体抗病毒检测等病毒学研究。
本研究初步分离到1株新型冠状病毒,对病毒的复制特性、细胞适应性等还待深入研究。该毒株的成功分离将为2019-nCoV致病机制的研究及其相关疫苗、药物的研制提供重要的毒种资源。
| [1] |
Zhu N, Zhang D, Wang W, Li X, Yang B, Song J, Zhao X, Huang B, Shi W, Lu R, Niu P, Zhan F, Ma X, Wang D, Xu W, Wu G, Gao GF, Tan W. China Novel Coronavirus Investigating and Research Team.A novel coronavirus from patients with pneumonia in China, 2019[J]. N Engl J Med, 2020, 382(8): 727-733.
[DOI]
|
| [2] |
Wang C, Horby PW, Hayden FG, Gao GF. A novel coronavirus outbreak of global health concern[J]. Lancet, 2020, 395(10223): 470-473.
[DOI]
|
| [3] |
Graham RL, Baric RS. Recombination, reservoirs, and the modular spike: mechanisms of coronavirus cross-species transmission[J]. J Virol, 2010, 84(7): 3134-3146.
[DOI]
|
| [4] |
Su S, Wong G, Shi W, Liu J, Lai ACK, Zhou J, Liu W, Bi Y, Gao GF. Epidemiology, genetic recombination, and pathogenesis of coronaviruses[J]. Trends Microbiol, 2016, 24(6): 490-502.
[DOI]
|
| [5] |
Zhou P, Yang XL, Wang XG, Hu B, Zhang L, Zhang W, Si HR, Zhu Y, Li B, Huang CL, Chen HD, Chen J, Luo Y, Guo H, Jiang RD, Liu MQ, Chen Y, Shen XR, Wang X, Zheng XS, Zhao K, Chen QJ, Deng F, Liu LL, Yan B, Zhan FX, Wang YY, Xiao GF, Shi ZL. A pneumonia outbreak associated with a new coronavirus of probable bat origin[J]. Nature, 2020.
[DOI]
|
| [6] |
Li F, Li W, Farzan M, Harrison SC. Structure of SARS coronavirus spike receptor-binding domain complexed with receptor[J]. Science, 2005, 309(5742): 1864-1868.
[DOI]
|
| [7] |
Tennant BJ, Gaskell RM, Gaskell CJ. Studies on the survival of canine coronavirus under different environmental conditions[J]. Vet Microbiol, 1994, 42(2-3): 255-259.
[DOI]
|
| [8] |
Millet JK, Whittaker GR. Host cell proteases: Critical determinants of coronavirus tropism and pathogenesis[J]. Virus Res, 2015, 202: 120-134.
[DOI]
|
| [9] |
Costello DA, Millet JK, Hsia CY, Whittaker GR, Daniel S. Single particle assay of coronavirus membrane fusion with proteinaceous receptor-embedded supported bilayers[J]. Biomaterials, 2013, 34(32): 7895-7904.
[DOI]
|
| [10] |
Matsuyama S, Ujike M, Morikawa S, Tashiro M, Taguchi F. Protease-mediated enhancement of severe acute respiratory syndrome coronavirus infection[J]. Proc Natl Acad Sci USA, 2005, 102(35): 12543-12547.
[DOI]
|
 2020, Vol. 15
2020, Vol. 15


