甲病毒属于披膜病毒科,其基因组为单股正链RNA,主要通过节肢动物传播,可以感染多种包括人类在内的脊椎动物和无脊椎动物。甲病毒可分为旧世界甲病毒和新世界甲病毒两类。旧世界甲病毒包括基孔肯亚病毒(Chikungunya virus, CHIKV)、马雅罗病毒(Mayaro virus, MAYV)、阿良良病毒(O’nyong-nyong virus, ONNV)、罗斯河病毒(Ross river virus, RRV)、辛德毕斯病毒(Sindbis virus, SINV) 和塞姆利基森林病毒(Semliki forest virus, SFV)等,主要导致流行性急性和慢性关节炎;新世界甲病毒包括东方马脑炎病毒(eastern equine encephalitis virus, EEEV)、委内瑞拉马脑炎病毒(Venezuelan equine encephalitis virus, VEEV)和西方马脑炎病毒(western equine encephalitis virus, WEEV),通过地方性周期性传播,可感染大脑中的神经元细胞,导致脑炎甚至死亡[1]。甲病毒基因组全长约12 kb,具有5’帽和3’多聚腺苷酸尾,包含2个开放阅读框(open reading frame,ORF),分别编码4个非结构蛋白(nonstructural protein,nsp)nsp1~nsp4和5个结构蛋白(C,E3,E2,6K,E1)[2]。甲病毒入侵靶细胞第一步是通过与靶细胞表面黏附因子结合进而与特异性受体相互作用来实现的[3]。已有文献报道了甲病毒相关的黏附因子和特异性受体,包括C型凝集素(C-type lectin)[4]、硫酸乙酰肝素(heparan sulfate,HS)[5-6]、Mxra8 (matrix remodeling associated 8)[7]、低密度脂蛋白受体A类结构域3(low density lipoprotein receptor class A domain containing 3,LDLRAD3)[8]、极低密度脂蛋白受体(very low density lipoprotein receptor,VLDLR)[9]等。目前,仍有一些致关节炎甲病毒(如CHIKV)在全世界范围内传播。尽管甲病毒存在传播流行的风险,但由于某些甲病毒(如CHIKV、VEEV等)需要在生物安全三级实验室甚至安全等级更高的实验室开展研究,极大阻碍了该领域的发展。此外,目前没有针对甲病毒的特异性抗病毒药物和疫苗被获批用于临床治疗。
假病毒具有可操作性强、生物风险低、检测方便、灵敏度高等优势,故被广泛应用于高致病性病毒的研究,如冠状病毒 [10-11]、埃博拉病毒[12]、流感病毒[13]、CHIKV[14]、汉坦病毒[15]等。假病毒可以模拟活病毒感染的入胞过程[16],也可以测量与活病毒相关抗体的效价[17-18]。本研究构建了基于鼠白血病病毒(murine leukemia virus, MLV)基因组的假病毒系统,通过质粒转染将编码MLV-gag/pol及异源病毒包膜蛋白的基因导入细胞表达,携带异源病毒包膜蛋白的假病毒颗粒会分泌到细胞培养基中[19-20]。此外,利用甲病毒成员基因组的兼容性,本研究还构建了基于SINV的病毒复制子颗粒(virus replicon particle, VRP)系统,采用报告基因如绿色荧光蛋白(green fluorescence protein, GFP)基因取代结构蛋白基因,而编码不同甲病毒成员结构蛋白的基因则通过反式互补表达,辅助包装出具备单轮感染特性的VRP。通过对甲病毒入侵感染相关的宿主因子如HS和受体Mxra8进行验证,来说明假病毒和VRP能够反映活病毒的入胞特征,从而为研究甲病毒家族成员的入侵感染机制和抗病毒策略等提供安全可靠的实验工具。
1 材料与方法 1.1 材料 1.1.1 细胞和感受态细胞293T细胞、BHK-21细胞、MEF细胞、MEF B3gat3(beta-1, 3-glucuronyltransferase 3)敲除细胞、MEF Mxra8敲除细胞均由本实验室保存,大肠埃希菌Stbl3感受态细胞购自Thermo公司。
1.1.2 质粒pCAGGS载体质粒、pSINV、pCAGGS-Capsid、MLV-gag/pol和pMIG-GFP均由本实验室保存。
1.1.3 试剂本研究所用试剂包括AxyPrep DNA Gel Extraction Kit(Axygen,AP-GX-250)、NucleoSpin Plasmid Mini kit (MN,740588.250)、MUL Assembly Cloning Kit(朗晶生物,PT008-200)、Polybrene(Sigma,TR-1003-G)、NEBNext Ultra Ⅱ Q5 Master Mix(NEB,M0544L)、XhoⅠ(NEB,R0146S)、EcoRI(NEB,R3101S)、EZ-Trans转染试剂(李记生物,AC04L092)。
1.2 方法 1.2.1 甲病毒包膜蛋白编码序列的合成根据GenBank公布的甲病毒成员序列,将以下病毒的包膜蛋白(E3-E2-6K-E1)基因交由苏州金唯智生物科技有限公司合成:SINV(U38305.1)、CHIKV-AF(EF452493.1)、CHIKV-LR(KY575571.1)、CHIKV-181/25(MT635337.1)、VEEV(L01442.2)、WEEV(KJ554983.1)和EEEV(AY705241.1)。
1.2.2 甲病毒包膜蛋白序列的扩增使用SnapGene软件设计聚合酶链反应(polymerase chain reaction, PCR)引物,以合成的包膜蛋白序列为模板,对甲病毒包膜蛋白序列进行PCR扩增。PCR产物经过1%琼脂糖凝胶电泳后切胶回收。
1.2.3 重组质粒pCAGGS-env的构建与鉴定利用XhoⅠ和EcoRI对pCAGGS载体质粒进行双酶切,获得线性化质粒载体。通过MUL Assembly Cloning Kit将PCR产物分别和pCAGGS线性化载体片段进行无缝连接,获得包含甲病毒包膜蛋白的质粒pC-env-SINV、pC-env-CHIKV-AF、pC-env-CHIKV-LR、pC-env-CHIKV-181/25、pC-env-VEEV、pC-env-WEEV和pC-env-EEEV。对获得的质粒进行酶切鉴定,将鉴定结果符合预期的质粒送苏州金唯智生物科技有限公司进行测序。
1.2.4 病毒颗粒的包装将处于对数生长期的293T细胞铺于12孔板中,24 h后,在细胞密度达到70%~90%时准备转染。
假病毒颗粒包装:每孔加入的质粒总量为1.37 μg,各质粒比例为pC-env∶MLV-gag/pol∶pMIG-GFP=0.74∶1∶1。按4∶1的质量比使用EZ Trans转染试剂将各质粒共转染进293T细胞,转染48 h后收集上清液并于-80 ℃保存。
复制子颗粒包装:每孔加入的质粒总量为1 μg,各质粒比例为pC-env∶pSINV-GFP∶pC-capsid=1∶1∶1。使用EZ Trans转染试剂按4:1的质量比将各质粒共转染进293T细胞,转染后48 h收集上清液并于-80 ℃保存。
1.2.5 感染实验将处于对数生长期的细胞铺于96孔板中,24 h后,在细胞密度达到90%~100%时准备感染。
假病毒颗粒感染实验:每孔加入100 μL病毒悬液(30 μL病毒+70 μL含2%胎牛血清和6 μg/mL polybrene的培养基)进行感染。感染24 h后,换成新鲜的含2%胎牛血清的培养基继续培养。感染48 h后,利用荧光显微镜和流式细胞仪检测病毒感染效率。
复制子颗粒感染实验:每孔加入100 μL稀释后的病毒悬液(30 μL病毒+70 μL含2%胎牛血清的培养基)进行感染。感染24 h后,利用荧光显微镜和流式细胞仪检测病毒感染效率。
1.3 统计学分析通过Graphpad Prism 8进行统计学分析和绘图。组间比较采用one-way ANOVA分析,P<0.05表示差异具有统计学意义。
2 结果 2.1 含甲病毒包膜蛋白的假病毒颗粒的构建使用三质粒系统包装假病毒,包括表达甲病毒包膜蛋白的表达质粒(pC-env)、包装质粒(MLV-gag/pol)和转移质粒(pMIG-GFP),构建策略如图所示(见图 1A)。将三质粒共转染进293T细胞,48 h后收集细胞上清液,感染BHK-21细胞,并通过荧光显微镜和流式细胞术检测GFP的表达(见图 1B、1C)。结果显示,所有假病毒颗粒均能检测到荧光蛋白的表达,表明假病毒颗粒包装成功。
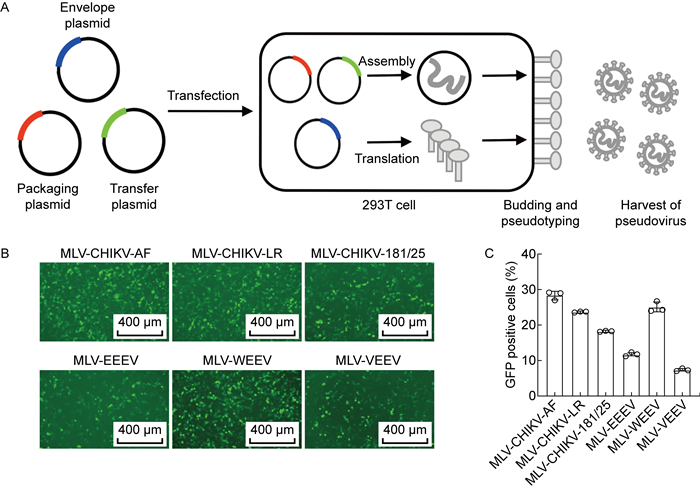
|
| A: Schematic diagram of pseudovirus construction. B: Fluorescence microscopy of pseudovirus infection on BHK-21 cells. C: Flow cytometry analysis of pseudovirus infection on BHK-21 cells. 图 1 假病毒的构建流程和细胞感染 Fig. 1 Schematic diagram of pseudovirus construction and cell infection |
假病毒能在一定程度上模拟活病毒的入胞感染过程。因此,本研究利用假病毒感染验证HS和Mxra8对入胞的影响。用假病毒感染B3gat3基因敲除的MEF细胞,同时以野生型细胞做对照,发现所有假病毒在敲除细胞中的感染效率均显著降低。在Mxra8基因敲除细胞中,只有包膜蛋白源自CHIKV的假病毒感染效率明显降低(P<0.000 1),而致脑炎甲病毒成员的假病毒感染未受到影响(见图 2A、2B)。以上结果表明,HS是甲病毒入胞相关的通用宿主因子,而Mxra8是致关节炎甲病毒的特异性入胞受体,与已发表的结果一致[5-7]。因此,本研究认为建立包装的假病毒是研究甲病毒入侵感染过程的有效工具。
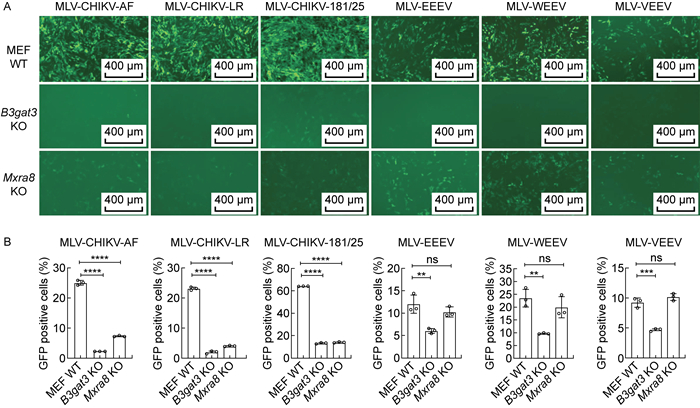
|
| A: Fluorescence microscopy of pseudovirus infection on MEF WT cells, B3gat3 KO cells and Mxra8 KO cells. B: Flow cytometry analysis of pseudovirus infection on MEF WT cells, B3gat3 KO cells and Mxra8 KO cells, **P<0.01, ***P<0.001, ****P<0.000 1 compared with MEF WT group. KO: knockout. 图 2 假病毒在验证入胞感染中的应用 Fig. 2 Application of pseudovirus in verification of intracellular infection |
本研究还构建了基于SINV基因组骨架的VRP三质粒系统:pSINV-GFP、pC-env和pC-Capsid,分别为26S启动表达GFP报告基因的SINV基因组、表达不同甲病毒成员的包膜蛋白E3-E2-6K-E1及SINV的衣壳蛋白,具体的构建策略如图 3A所示。首先构建了SINV VRP,即由SINV提供自身包膜蛋白。将三质粒共转染到293T细胞,转染后24 h到48 h,可以观察到GFP阳性细胞增多(见图 3B)。为了验证SINV VRP的感染性,用收集的SINV VRP感染293T细胞,可以观察到荧光信号(见图 3C)。为了验证单轮感染复制子颗粒的安全性,将获得的复制子颗粒进行连续传代。经过2次传代后,细胞均不表达GFP(见图 3D),表明安全的单轮感染复制子颗粒可以替代活病毒来研究其入侵特性等。
|
| A: Schematic diagram of VRP construction. B: Fluorescence microscopy of three-plasmid co-transfection. C: Fluorescence microscopy of SINV VRP infection on 293T cells. D: Safety verification of SINV VRP by fluorescence microscopy. hpi: hours post infection. P1: the first passage; P2: the second passage. 图 3 VRP的构建流程和安全性验证 Fig. 3 Schematic diagram of VRP construction and safety verification |
由于甲病毒基因组及其编码蛋白的相似性,不同成员间具有灵活的兼容性,可以构建含不同甲病毒包膜蛋白的嵌合VRP。因此,本研究仅通过替换表达包膜蛋白的pCAGGS-env质粒,分别包装了CHIKV-AF、CHIKV-181/25、EEEV、WEEV的嵌合VRP。在转染后24 h到48 h,可以观察到GFP阳性细胞明显增多(见图 4A)。同时,将收集的上清液感染MEF细胞,可以观察到GFP阳性细胞(见图 4B),表明不同甲病毒成员的SINV嵌合VRP包装成功。

|
| A: Fluorescence microscopy of three-plasmid co-transfection. B: Fluorescence microscopy of VRP infection on MEF cells. hpi: hours post infection. 图 4 构建含不同甲病毒成员包膜蛋白的VRP Fig. 4 Construction of VRPs containing different alphavirus envelope proteins |
因为单轮感染的VRP可以替代活病毒成为研究入侵感染相关宿主因子的工具,本研究利用上述构建的嵌合VRP感染验证HS和Mxra8对病毒入侵的影响。与之前假病毒感染结果相似,所有VRP感染效率在B3gat3基因敲除细胞中均显著降低,而VRP感染Mxra8基因敲除细胞时,只有含CHIKV包膜蛋白的VRP感染效率明显降低,含致脑炎甲病毒EEEV和WEEV包膜蛋白的VRP感染效率没有明显变化(见图 5A、5B)。结果表明,HS是甲病毒入侵相关的通用宿主因子,而Mxra8只特异性地影响致关节炎甲病毒如CHIKV的入侵感染,与之前文献报道的结论一致[5-7]。
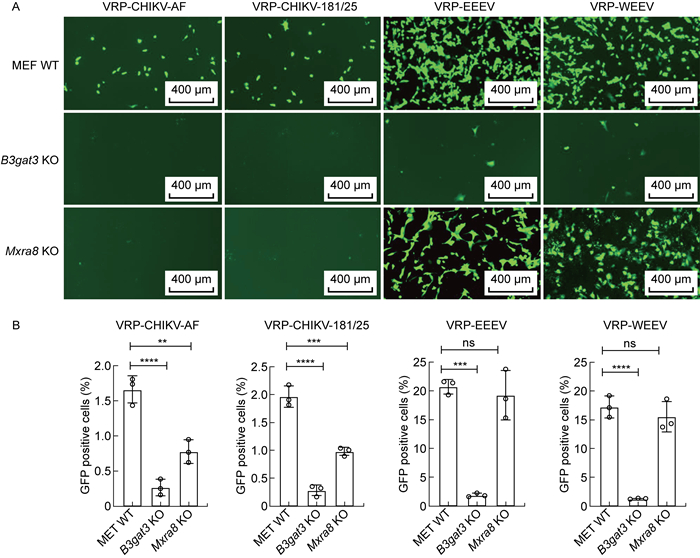
|
| A: Fluorescence microscopy of VRP infection on MEF WT cells, B3gat3 KO cells and Mxra8 KO cells. B: Flow cytometry analysis of VRP infection on MEF WT cells, B3gat3 KO cells and Mxra8 KO cells. **P<0.01, ***P<0.001, ****P<0.000 1 compared with MEF WT group. KO: knockout. 图 5 VRP在验证入胞感染中的应用 Fig. 5 Application of VRP in verification of intracellular infection |
甲病毒成员可通过节肢动物如蚊虫进行传播,威胁公共卫生安全并具有潜在暴发流行的风险。近年来,一些社会和生态因素影响了节肢动物的地理分布,甲病毒开始在世界范围内传播和流行,并伴有较高的发病率和死亡率。目前,尚没有具体的策略来应对和预防甲病毒感染。甲病毒入侵靶细胞的第一步是通过病毒表面包膜糖蛋白与特异性受体结合来实现的,因此研究甲病毒的入胞机制,开发阻断病毒入胞的抗病毒策略,具有重要意义。
尽管甲病毒成员之间具有相似性,包装的假病毒也表达了相似的结构蛋白,但包装效率仍表现出了一定的差异。假病毒的包装效率受多种因素的影响,不同的包装系统会影响其包装效率。常见的假病毒包装系统包括MLV包装系统、慢病毒载体包装系统和水疱性口炎病毒包装系统,可以尝试用其他假病毒包装系统对MLV包装系统包装效率低的甲病毒进行重新包装测试;还可以通过优化包装系统中的质粒提高假病毒的滴度,改变外源基因插入的位置或者通过强启动子驱动外源基因,使获得的病毒滴度提高100~1 000倍[12];此外,不同的转染试剂、转染质粒的比例、转染试剂与质粒的比例以及转染时的细胞系选择,也会影响假病毒包装效率。
本研究图 2A中,MLV-EEEV、MLV-WEEV和MLV-VEEV在Mxra8敲除细胞中的荧光强度明显低于在MEF野生型细胞中的荧光强度,而图 2B中统计分析的差异不显著;同样,图 5A中,VRP-EEEV和VRP-WEEV在Mxra8敲除细胞中的荧光强度也有所降低,但图 5B中统计分析的差异亦不显著。这种结果的差异可能是不同检测手段导致的。荧光显微镜下视野选择具有随机性,用来观察部分细胞的荧光表达水平;流式细胞术检测全部细胞的荧光表达情况,能反映整体细胞的荧光表达水平。此外,荧光显微镜无法辨别表达弱荧光信号的细胞;而流式细胞术的检测灵敏度更高,可以捕捉更多表达弱荧光信号的细胞。
目前,甲病毒复制子系统开发常用的甲病毒包括SINV[21]、SFV[22]和VEEV[23]。本研究在包装SINV、CHIKV-AF和CHIKV-181/25的VRP时,包装效率较低,收集的上清液中感染细胞比例低,而在包装EEEV和WEEV的VRP时,包装效率较高,这可能是SINV VRP系统对包膜蛋白序列的兼容性不同导致的。由于VRP系统的可行性和适用性需要验证,VRP感染效率低会影响后续实验结果的观察分析和判断,因此可以尝试通过构建基于SFV或VEEV的VRP系统来提高包装效率,或者基于CHIKV包装CHIKV-AF和CHIKV-181/25的VRP。收获的VRP可感染多种细胞系并确定易感细胞系,有助于后续实验中不同实验条件下细胞系的选择。
本研究在构建VRP时,将衣壳蛋白基因与包膜蛋白基因分别克隆到2个独立的质粒中表达。这种构建策略与衣壳蛋白和包膜蛋白被克隆到同一质粒表达的构建策略相比,具有一定的优势。首先,同一质粒表达衣壳蛋白和包膜蛋白,只须发生一次重组就能获得完整的病毒基因组,而分别表达衣壳蛋白和包膜蛋白,须发生2次重组才能产生完整的病毒基因组,形成野生型病毒,重组率低,安全性更高。此外,用同一质粒表达衣壳蛋白和包膜蛋白时,会引入突变使得p62丧失细胞内剪切功能,由此产生的病毒颗粒需要糜蛋白酶的激活才能具有感染性,应用难度大,使用成本较高,而分别表达衣壳蛋白和包膜蛋白时,不用引入p62的突变,不需要糜蛋白酶的激活,降低了操作难度,减少了使用成本,应用更为广泛[24-25]。
4 结论本研究成功构建了基于MLV的假病毒系统和基于SINV的VRP系统。两系统都产生了单轮感染性颗粒,可以在二级生物安全实验室进行操作,安全性较好;可以模拟甲病毒的真实感染过程,本研究利用这两种系统验证了B3gat3基因和Mxra8基因对甲病毒入侵过程的影响;同时表达荧光蛋白报告基因,可以便捷地量化检测结果。基于MLV的假病毒系统将基因整合到宿主基因组中,报告基因的表达更稳定,适合长时间检测。基于SINV的VRP系统利用了SINV的复制特性,可以更快速高效地合成所插入的报告基因,检测更灵敏,也能更真实地模拟活病毒的感染过程。此外,由于本研究构建的病毒颗粒只能完成一轮感染,无法还原活病毒持续感染诱导出的病变反应,存在一定的局限性。本研究构建的MLV假病毒系统和SINV VRP系统为研究甲病毒入侵和研发抗病毒药物提供了安全可靠的实验工具。
| [1] |
Ronca SE, Dineley KT, Paessler S. Neurological sequelae resulting from encephalitic alphavirus infection[J]. Front Microbiol, 2016, 7: 959.
|
| [2] |
Weaver SC, Barrett AD. Transmission cycles, host range, evolution and emergence of arboviral disease[J]. Nat Rev Microbiol, 2004, 2(10): 789-801.
[DOI]
|
| [3] |
Holmes AC, Basore K, Fremont DH, Diamond MS. A molecular understanding of alphavirus entry[J]. PLoS Pathog, 2020, 16(10): e1008876.
[DOI]
|
| [4] |
Klimstra WB, Nangle EM, Smith MS, Yurochko AD, Ryman KD. DC-SIGN and L-SIGN can act as attachment receptors for alphaviruses and distinguish between mosquito cell-and mammalian cell-derived viruses[J]. J Virol, 2003, 77(22): 12022-12032.
[DOI]
|
| [5] |
Klimstra WB, Ryman KD, Johnston RE. Adaptation of Sindbis virus to BHK cells selects for use of heparan sulfate as an attachment receptor[J]. J Virol, 1998, 72(9): 7357-7366.
[DOI]
|
| [6] |
Gardner CL, Ebel GD, Ryman KD, Klimstra WB. Heparan sulfate binding by natural eastern equine encephalitis viruses promotes neurovirulence[J]. Proc Natl Acad Sci USA, 2011, 108(38): 16026-16031.
[DOI]
|
| [7] |
Zhang R, Kim AS, Fox JM, Nair S, Basore K, Klimstra WB, Rimkunas R, Fong RH, Lin H, Poddar S, Crowe JJ, Doranz BJ, Fremont DH, Diamond MS. Mxra8 is a receptor for multiple arthritogenic alphaviruses[J]. Nature, 2018, 557(7706): 570-574.
[DOI]
|
| [8] |
Ma H, Kim AS, Kafai NM, Earnest JT, Shah AP, Case JB, Basore K, Gilliland TC, Sun C, Nelson CA, Thackray LB, Klimstra WB, Fremont DH, Diamond MS. LDLRAD3 is a receptor for Venezuelan equine encephalitis virus[J]. Nature, 2020, 588(7837): 308-314.
[DOI]
|
| [9] |
Clark LE, Clark SA, Lin C, Liu J, Coscia A, Nabel KG, Yang P, Neel DV, Lee H, Brusic V, Stryapunina I, Plante KS, Ahmed AA, Catteruccia F, Young-Pearse TL, Chiu IM, Llopis PM, Weaver SC, Abraham J. VLDLR and ApoER2 are receptors for multiple alphaviruses[J]. Nature, 2022, 602(7897): 475-480.
[DOI]
|
| [10] |
Kobinger GP, Limberis MP, Somanathan S, Schumer G, Bell P, Wilson JM. Human immunodeficiency viral vector pseudotyped with the spike envelope of severe acute respiratory syndrome coronavirus transduces human airway epithelial cells and dendritic cells[J]. Hum Gene Ther, 2007, 18(5): 413-422.
[DOI]
|
| [11] |
Fan C, Wu X, Liu Q, Li Q, Liu S, Lu J, Yang Y, Cao Y, Huang W, Liang C, Ying T, Jiang S, Wang Y. A human DPP4-knockin mouse's susceptibility to infection by authentic and pseudotyped MERS-CoV[J]. Viruses, 2018, 10(9): 448.
[DOI]
|
| [12] |
Liu Q, Fan C, Li Q, Zhou S, Huang W, Wang L, Sun C, Wang M, Wu X, Ma J, Li B, Xie L, Wang Y. Antibody-dependent-cellular-cytotoxicity-inducing antibodies significantly affect the post-exposure treatment of Ebola virus infection[J]. Sci Rep, 2017, 7: 45552.
[DOI]
|
| [13] |
Lu Y, Jiang T. Pseudovirus-based neuraminidase inhibition assays reveal potential H5N1 drug-resistant mutations[J]. Protein Cell, 2013, 4(5): 356-363.
[DOI]
|
| [14] |
Wu J, Zhao C, Liu Q, Huang W, Wang Y. Development and application of a bioluminescent imaging mouse model for Chikungunya virus based on pseudovirus system[J]. Vaccine, 2017, 35(47): 6387-6394.
[DOI]
|
| [15] |
Ning T, Wang L, Liu S, Ma J, Nie J, Huang W, Li X, Li Y, Wang Y. Monitoring neutralization property change of evolving hantaan and seoul viruses with a novel pseudovirus-based assay[J]. Virol Sin, 2021, 36(1): 104-112.
[DOI]
|
| [16] |
Li Q, Liu Q, Huang W, Li X, Wang Y. Current status on the development of pseudoviruses for enveloped viruses[J]. Rev Med Virol, 2018, 28(1): e1963.
[DOI]
|
| [17] |
Wright E, Temperton NJ, Marston DA, McElhinney LM, Fooks AR, Weiss RA. Investigating antibody neutralization of lyssaviruses using lentiviral pseudotypes: a cross-species comparison[J]. J Gen Virol, 2008, 89(Pt 9): 2204-2213.
[DOI]
|
| [18] |
Zhou S, Liu Q, Wu X, Chen P, Wu X, Guo Y, Liu S, Liang Z, Fan C, Wang Y. A safe and sensitive enterovirus A71 infection model based on human SCARB2 knock-in mice[J]. Vaccine, 2016, 34(24): 2729-2736.
[DOI]
|
| [19] |
Millet JK, Whittaker GR. Host cell entry of Middle East respiratory syndrome coronavirus after two-step, furin-mediated activation of the spike protein[J]. Proc Natl Acad Sci USA, 2014, 111(42): 15214-15219.
[DOI]
|
| [20] |
Millet JK, Whittaker GR. Murine leukemia virus (MLV)-based coronavirus spike-pseudotyped particle production and infection[J]. Bio Protoc, 2016, 6(23): e2035.
[DOI]
|
| [21] |
Xiong C, Levis R, Shen P, Schlesinger S, Rice CM, Huang HV. Sindbis virus: an efficient, broad host range vector for gene expression in animal cells[J]. Science, 1989, 243(4895): 1188-1191.
[DOI]
|
| [22] |
Liljestrom P, Garoff H. A new generation of animal cell expression vectors based on the Semliki Forest virus replicon[J]. Biotechnology (NY), 1991, 9(12): 1356-1361.
[DOI]
|
| [23] |
Davis NL, Willis LV, Smith JF, Johnston RE. In vitro synthesis of infectious Venezuelan equine encephalitis virus RNA from a cDNA clone: analysis of a viable deletion mutant[J]. Virology, 1989, 171(1): 189-204.
[DOI]
|
| [24] |
Berglund P, Sjöberg M, Garoff H, Atkins GJ, Sheahan BJ, Liljeström P. Semliki Forest virus expression system: production of conditionally infectious recombinant particles[J]. Biotechnology (NY), 1993, 11(8): 916-920.
[DOI]
|
| [25] |
Tubulekas I, Liljeström P. Suppressors of cleavage-site mutations in the p62 envelope protein of Semliki Forest virus reveal dynamics in spike structure and function[J]. J Virol, 1998, 72(4): 2825-2831.
[DOI]
|
 2023, Vol. 18
2023, Vol. 18


