2. 新乡医学院人民医院,河南 郑州 450003;
3. 郑州大学人民医院,河南 郑州 450003;
4. 河南省人民医院骨科一病区,河南 郑州 450003
2. People's Hospital of Xinxiang Medical College, Zhengzhou 450003, Henan Province, China;
3. People's Hospital of Zhengzhou University, Zhengzhou 450003, Henan Province, China;
4. The First Ward of the Orthopedics Department, Henan Provincial People's Hospital, Zhengzhou 450003, Henan Province, China
关节假体周围感染(periprosthetic joint infection,PJI) 被称为关节置换术后灾难性并发症,PJI的治疗通常分阶段进行,且患者每次手术入院的死亡率增加2倍[1],2001—2009年,美国的人工关节感染年发病率呈升高趋势,其中髋关节置换术的感染率从1.99%增至2.18%,膝关节置换术的感染率从2.05%增至2.18%[2]。PJI的高死亡率和发病率使其成为关节置换术后的重大挑战。然而,PJI的诊断和治疗还面临另一个难题:细菌培养阴性结果的普遍存在,这在PJI的诊疗过程给矫形外科医生带来了巨大挑战。细菌生物膜在假体表面黏附,通过微菌落形成、成熟、释放的动态过程,进一步增加了PJI患者的诊疗难度。研究表明,各类病原菌均可引发PJI,应用敏感抗生素治疗是成功治疗PJI的基础。结合临床实际,PJI患者细菌培养阴性的比例约为3%~5.2%[3-4]。因此,分析PJI病原菌流行病学数据可以指导临床预防和经验性用药,减少耐药菌的产生,并对PJI的发病机制、诊断、治疗具有重要的参考意义。故本项研究旨在采用Meta分析方法,系统评价PJI发生后的病原菌分布与耐药性情况,以期为指导PJI的诊疗提供依据。
1 资料与方法 1.1 文献检索由第一和第三作者在电子数据库(包括中国知网、万方医学网及英文数据库)、英文电子数据库(主要为PubMed)进行文献检索。中文检索词为PJI、假体周围感染、耐药、病原菌、微生物;英文检索词为PJI,pathogen,bacteria,structure,drug resistance。检索时间:各数据库建库至2022年11月8日。具体文献检索策略如表 1所示(仅以中国知网数据库检索策略为例)。
| 序号 | 检索词 |
| #1 | PJI |
| #2 | 假体周围感染 |
| #3 | 耐药 |
| #4 | 病原菌 |
| #5 | 微生物 |
| #6 | 1 and 3 in标题 |
| #7 | 2 and 3 in标题 |
| #8 | 1 and 4 in所有字段 |
| #9 | 2 and 4 in所有字段 |
| #10 | 1 and 5 in关键词 |
| #11 | 2 and 5 in关键词 |
根据澳大利亚Joanna Briggs Institute(JBI)循证卫生保健中心对分析性横断面研究的真实性评价标准,提取了5项质量评估标准,评分为0~3分的文献被定为低质量文献,4~5分被定为高质量文献,纳入文献的详细得分如表 2所示。任何分歧都以协商一致的方式解决。对符合条件的研究提取以下数据:作者姓名、发表年份、研究地点、样本量、感染细菌分类。
| 作者及发表时间(年) | 地区 | 总病例数 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | 得分 |
| 陈洁等,2016 | 中国 | 27 | 18 | 6 | 1 | 2 | 5 |
| 彭慧明等,2019 | 中国 | 251 | 209 | 29 | 10 | 3 | 4 |
| 周历程等,2021 | 中国 | 223 | 157 | 44 | 21 | 1 | 5 |
| 张理昂等,2009 | 中国 | 29 | 23 | 6 | 0 | 0 | 5 |
| 彭慧明等,2013 | 中国 | 19 | 14 | 2 | 1 | 2 | 4 |
| 唐旭等,2016 | 中国 | 21 | 15 | 4 | 2 | 0 | 5 |
| 穆文博等,2019 | 中国 | 31 | 24 | 6 | 1 | 0 | 5 |
| 黄子达等,2019 | 中国 | 20 | 14 | 2 | 2 | 2 | 5 |
| 张泽宇等,2021 | 中国 | 32 | 24 | 3 | 3 | 2 | 4 |
| 杨云建等,2014 | 中国 | 53 | 39 | 12 | 1 | 1 | 4 |
| 周一逸等,2019 | 中国 | 43 | 23 | 18 | 2 | 0 | 5 |
| 闫开成等,2022 | 中国 | 112 | 90 | 15 | 6 | 1 | 4 |
| 何家伟等,2021 | 中国 | 144 | 109 | 25 | 10 | 0 | 5 |
| 陈志等,2019 | 中国 | 17 | 11 | 5 | 0 | 1 | 5 |
| 江旭等,2022 | 中国 | 71 | 41 | 21 | 9 | 0 | 4 |
| 王瑛等,2022 | 中国 | 150 | 116 | 32 | 2 | 0 | 4 |
| 陈志等,2020 | 中国 | 104 | 81 | 19 | 0 | 4 | 5 |
| 崔苛苛等,2017 | 中国 | 1 367 | 1 017 | 267 | 44 | 39 | 4 |
| 徐倩等,2020 | 中国 | 279 | 177 | 75 | 27 | 0 | 5 |
| 王娜等,2020 | 中国 | 319 | 247 | 69 | 3 | 0 | 4 |
| 陈仁德等,2019 | 中国 | 47 | 31 | 12 | 3 | 1 | 4 |
| Karczewski等,2022 | 德国 | 102 | 80 | 21 | 1 | 0 | 4 |
| Holleyman等,2016 | 英国 | 302 | 263 | 38 | 1 | 0 | 3 |
| Preobrazhensky等,2021 | 俄罗斯 | 312 | 289 | 21 | 2 | 0 | 4 |
| Klement等,2018 | 美国 | 263 | 235 | 23 | 3 | 2 | 5 |
| 评分标准: ①是否清晰界定了研究对象的纳入标准;②是否描述了研究对象及研究场所;③是否采用客观、标准的方法测评健康问题;④是否采用有效、可信的方法测评结局指标;⑤资料分析方法是否恰当。Ⅰ:革兰氏阳性菌;Ⅱ:革兰氏阴性菌;Ⅲ:真菌;Ⅳ:分枝杆菌。 | |||||||
为了确定符合纳入标准的文章并减少出错的风险,2名审稿人用相关关键词独立筛选数据库,并审查标题、摘要和全文,意见不一致时协商解决。纳入标准:①接受过关节置换的患者; ②病理确诊为PJI的患者;③检查部位无其他感染者;④可以提取足够数据进行分析。将同时满足以上4项标准的文献纳入研究。
1.3.2 排除标准① 重复数据;②动物实验;③会议摘要;④信件和评论文章;⑤数据不完整。对满足任意1项排除标准的文章进行排除。
1.4 统计分析使用STATA统计软件17.0版对数据进行Meta分析。通过I2检验来评估研究的异质性,并根据I2值的大小评估异质性,0~25%认为是低水平、25%~50%认为是中水平、大于50%认为是高水平。I2大于50%时使用随机效应模型,小于50%则使用固定效应模型。并根据PJI发生的部位(髋或膝)进行亚组分析。
2 结果 2.1 数据库搜索与研究特征根据本研究的全面搜索结果,有25项符合资格标准的研究(见图 1)被纳入Meta分析(陈洁等[5],2016年;彭慧明等[6],2019年;周历程等[7],2021年;张理昂等[8],2009年;彭慧明等[9],2013年;唐旭等[10],2016年;穆文博等[11],2019年;黄子达等[12],2019年;张泽宇等[13],2021年;杨云建等[14],2014年;周一逸等[15],2019年;闫开成等[16],2022年;何家伟等[17],2021年,陈志等[18],2019年;江旭等[19],2022年;王瑛等[20],2022年;陈志等[21],2020年;崔苛苛等[22],2017年;徐倩等[23],2020年;王娜等[24],2020年;陈仁德等[25],2019年;Karczewsk等[26],2022年;Holleyman等[27],2016年;Preobrazhensky等[28],2021年;Klement等[29],2018年)。所收录研究的全部特点记录于表 2,具体检索流程如图 1所示。
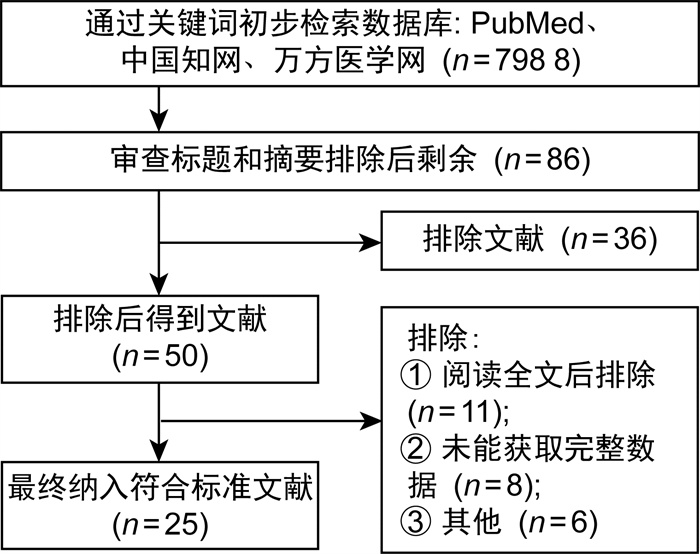
|
| 图 1 文献检索流程 Fig. 1 Flow chart of literature search |
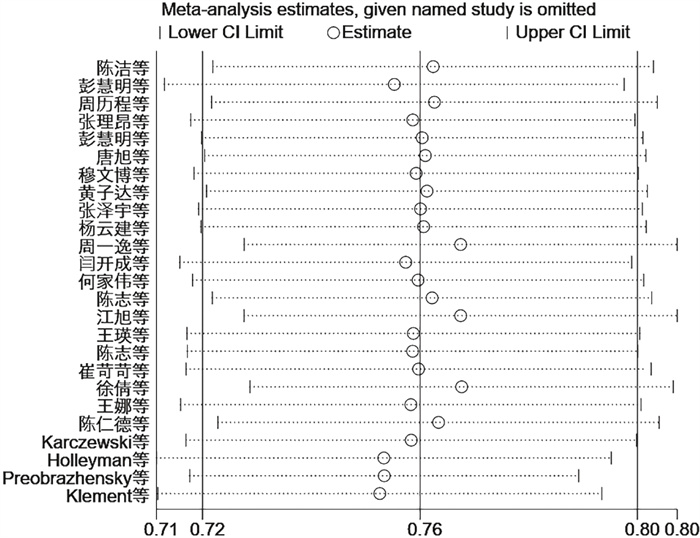
在25项研究中,革兰氏阳性菌的总患病率为76%(95%CI为[0.72, 0.80],见图 2)。25项研究间有显著性差异(P<0.001,I2=87.56%)。由于异质性较大,为了探究异质性来源,进行亚组分析(见图 3~5)。以感染部位为基础的亚组分析结果表明,PJI中革兰氏阳性致病菌在膝关节中的总感染率为75% (95%CI为(0.72, 0.77)),在髋关节中为76% (95%CI为(0.74, 0.78))(见表 3,P<0.001,I2=89.3%),分组间具有显著性差异,异质性仍较大,说明革兰氏阳性菌组异质性来源并非来源于分组类型。对革兰氏阳性菌组进行敏感性分析(见图 6),逐项剔除单个研究后的Meta分析结果显示,指标合并效应量的影响程度较小,说明纳入文献的稳定性好。
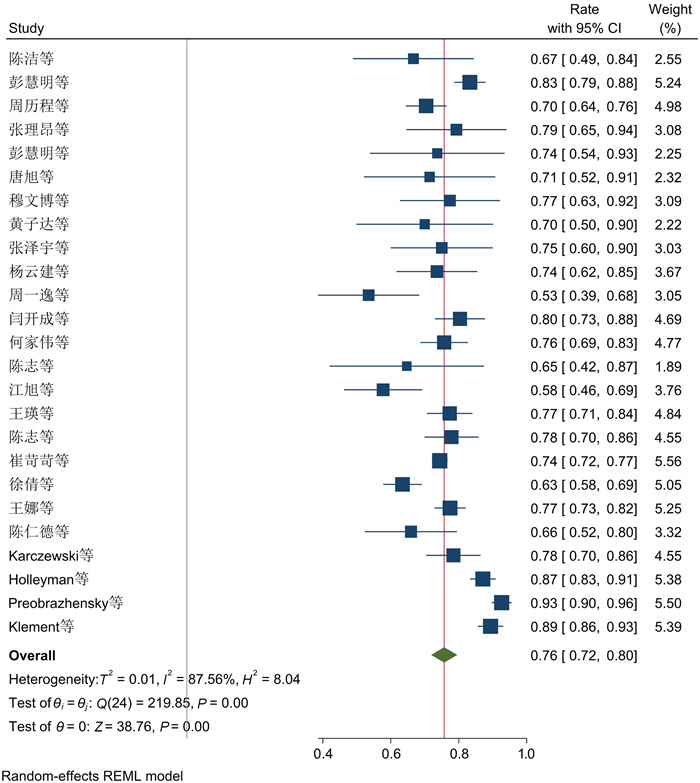
|
| 图 2 革兰氏阳性菌流行率Meta分析的森林图 Fig. 2 Forest plot of Meta-analysis on the prevalence of Gram-positive bacteria |
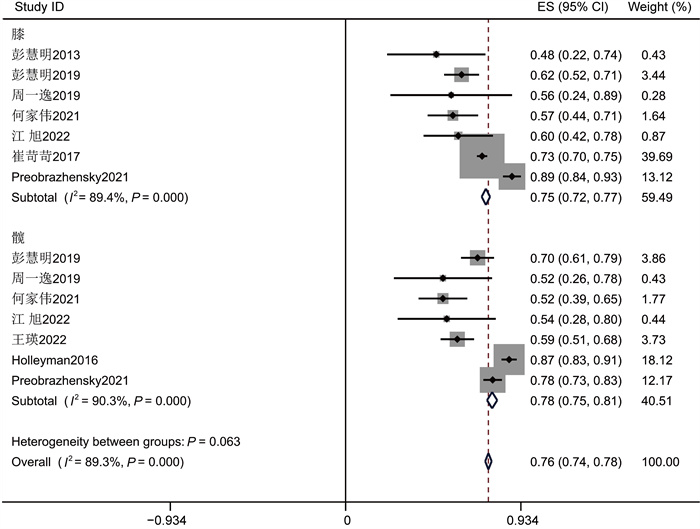
|
| 图 3 膝关节组和髋关节组革兰氏阳性菌流行率Meta分析的森林图 Fig. 3 The forest plot of Meta-analysis on the prevalence of Gram-positive bacteria in knee joint group and hip joint group |
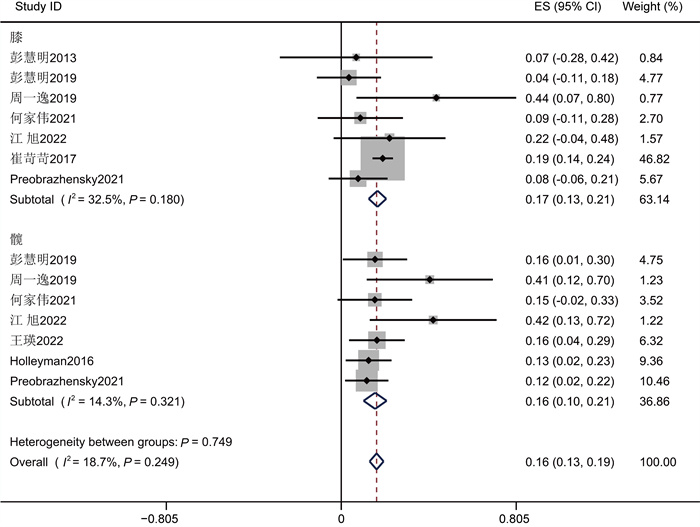
|
| 图 4 膝关节组和髋关节组革兰氏阴性菌流行率Meta分析的森林图 Fig. 4 The forest plot of the Meta-analysis on the prevalence of Gram-negative bacteria in the knee joint group and the hip joint group |
|
| 图 5 膝关节组和髋关节组真菌流行率Meta分析的森林图 Fig. 5 Forest plot of Meta-analysis on fungal prevalence in knee joint group and hip joint group |
| 细菌分类与部位 | 文献数量 | 流行率(%) | 异质性检验 | 发表偏倚检验 | |||||||
| 流行率 | (95%置信区间) | P值 | I2(%) | X2 | Z | P值 | |||||
| 革兰氏阳性菌 | 髋 | 7 | 78 | (75, 81) | <0.001 | 90.3 | 61.56 | 56.43 | <0.001 | ||
| 膝 | 7 | 75 | (72, 77) | <0.001 | 89.4 | 56.35 | 65.46 | <0.001 | |||
| 革兰氏阴性菌 | 髋 | 7 | 16 | (10, 21) | 0.321 | 14.3 | 7 | 5.75 | <0.001 | ||
| 膝 | 7 | 17 | (13, 21) | 0.18 | 32.5 | 8.89 | 8.05 | <0.001 | |||
| 真菌 | 髋 | 6 | 1 | (-5, 7) | 0.999 | 0 | 0.17 | 0.32 | 0.747 | ||
| 膝 | 6 | 4 | (-1, 8) | 0.893 | 0 | 1.67 | 1.71 | 0.087 | |||
|
| 图 6 革兰氏阳性菌组敏感性分析 Fig. 6 Sensitivity analysis on Gram-positive bacteria group |
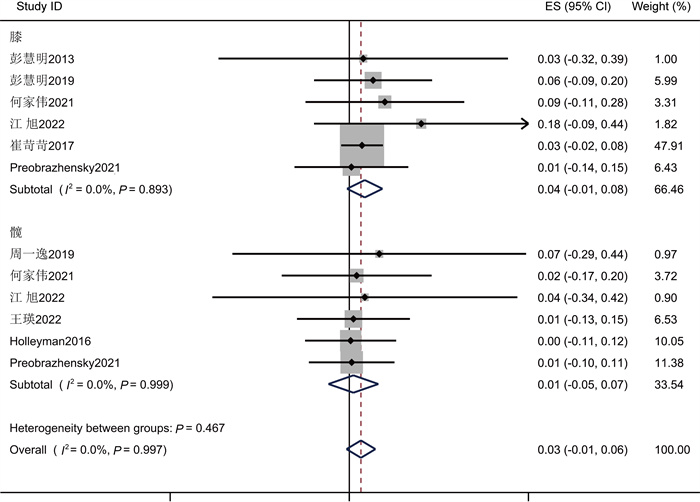
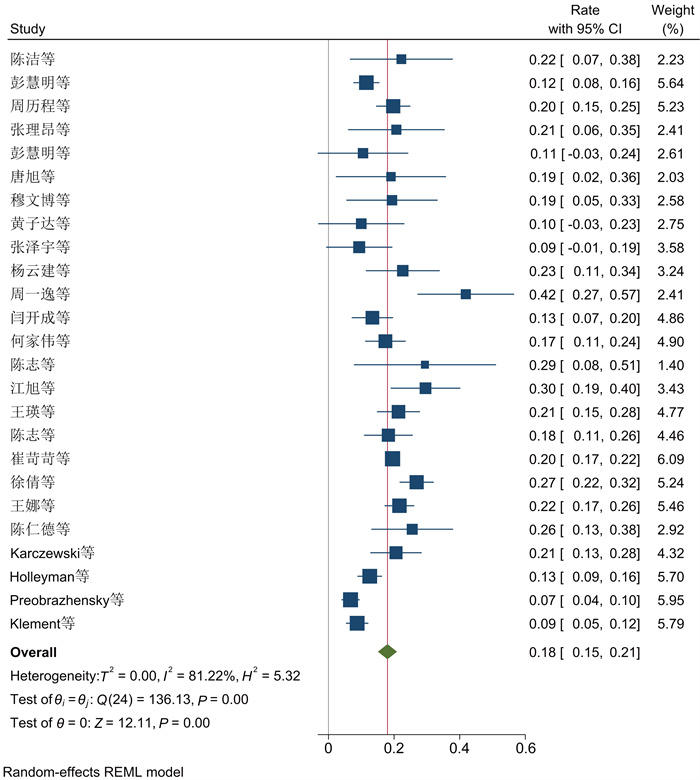
在25项研究中,革兰氏阴性菌的总患病率为18%(95%CI为[0.15, 0.21],见图 7)。25项研究间有显著性差异(P<0.001,I2=81.22%)。以感染部位为基础的亚组分析结果表明,PJI中革兰氏阴性致病菌在膝关节中的总感染率为17% (95%CI为(0.13, 0.21)),在髋关节中为16% (95%CI为(0.10, 0.21);P>0.05, I2=18.7%)(见表 3),分组间不具有显著性差异,异质性不明显,说明革兰氏阴性菌组异质性来源于分组类型。
|
| 图 7 革兰氏阴性菌流行率Meta分析的森林图 Fig. 7 Forest plot of Meta-analysis of the prevalence of Gram-negative bacteria |
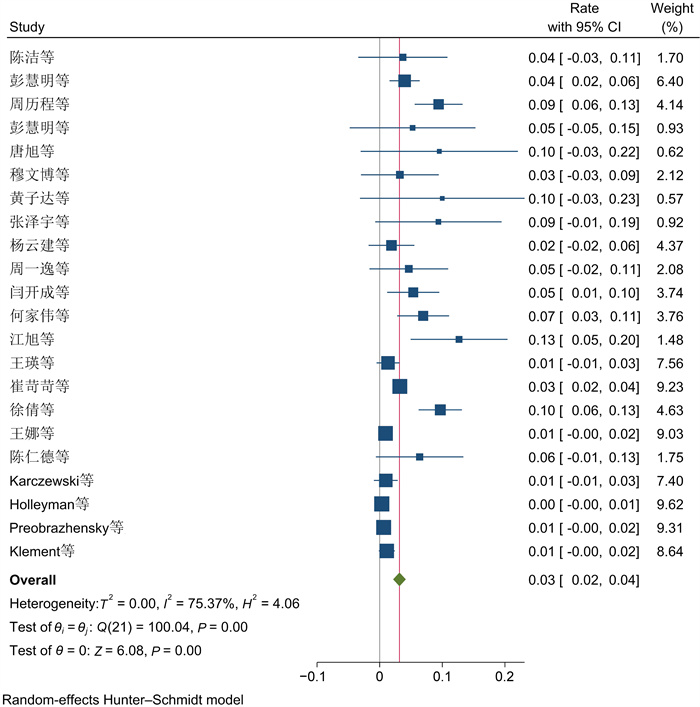
在22项研究中,真菌的总患病率为3% (95%CI为[0.02, 0.04],见图 8)。22项研究间差异有显著性(P<0.01,I2=75.37%)。以感染部位开展的亚组分析结果表明,PJI中,真菌在膝关节中的总感染率为4% (95%CI为(-0.01, 0.08)),在髋关节中为1% (95%CI为(-0.05, 0.07);P>0.05, I2=0.0%)(见表 3),分组间不具有显著性差异,异质性不明显,说明真菌组异质性来源于分组类型。
|
| 图 8 真菌流行率Meta分析的森林图 Fig. 8 Forest plot of Meta-analysis of fungal prevalence |
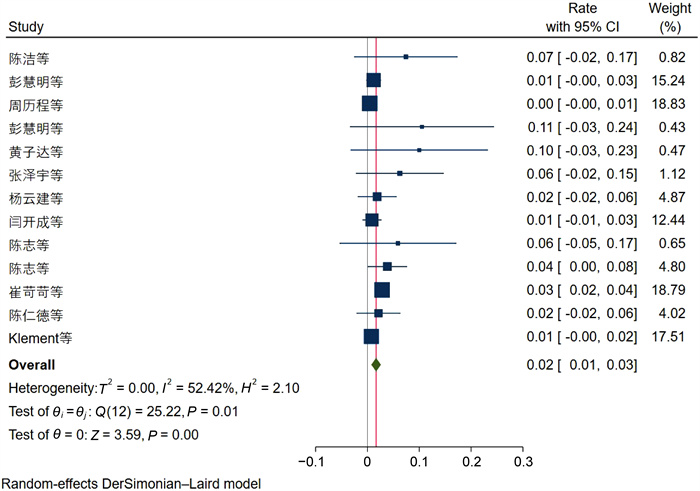
在13项研究中,分枝杆菌的总患病率为2%(95%CI为[0.01, 0.03],见图 9)。13项研究间差异有显著性(P<0.01,I2=52.42%)。由于分枝杆菌病例少见,分析数据收集较少,不再进行基于感染部位的亚组分析。
|
| 图 9 分枝杆菌流行率Meta分析的森林图 Fig. 9 Forest plot of Meta-analysis of mycobacterial prevalence |
本文对6篇文献[14, 16-17, 19-20, 24]中凝固酶阴性葡萄球菌与金黄色葡萄球菌的总株数、耐药株数进行统计,并据此分析它们对抗生素的耐药率,发现凝固酶阴性葡萄球菌对青霉素的耐药率最高,达95% (95% CI为(0.93, 0.98)), 其次是头孢拉定,耐药率为92%(95% CI为(0.87, 0.97)),耐药率较低的有四环素、利福平、莫西沙星和氨苄西林/舒巴坦,耐药率分别为12%(95% CI为(0.07, 0.17))、13%(95% CI为(0.08, 0.19))、13%(95% CI为(0.08, 0.18))和8%(95% CI为(0.03, 0.19));金黄色葡萄球菌耐药率最高的抗生素也是青霉素,耐药率为98%(95% CI为(0.96, 1.00)),耐药率较低的抗生素为莫西沙星,耐药率为13%(95% CI为(0.06, 0.19))。具体数据如表 4所示。
| 抗生素 | 凝固酶阴性葡萄球菌 | 金黄色葡萄球菌 | |||||||
| A/株 | B/株 | 耐药率(%) | 95%CI(%) | A/株 | B/株 | 耐药率(%) | 95%CI(%) | ||
| 青霉素 | 289 | 303 | 95 | (93, 98) | 181 | 185 | 98 | (96, 100) | |
| 红霉素 | 192 | 276 | 70 | (64, 75) | 126 | 185 | 68 | (61, 75) | |
| 磷霉素 | 5 | 24 | 21 | (0, 37) | 2 | 12 | 17 | (0, 38) | |
| 四环素 | 19 | 161 | 12 | (7, 17) | 20 | 96 | 21 | (13, 29) | |
| 利福平 | 21 | 158 | 13 | (8, 19) | 14 | 107 | 13 | (7, 19) | |
| 庆大霉素 | 133 | 304 | 44 | (38, 49) | 107 | 185 | 58 | (51, 65) | |
| 克林霉素 | 98 | 276 | 36 | (30, 41) | 94 | 185 | 51 | (44, 58) | |
| 莫西沙星 | 21 | 161 | 13 | (8, 18) | 12 | 96 | 13 | (6, 19) | |
| 丙环沙星 | 125 | 279 | 45 | (39, 51) | 64 | 173 | 37 | (30, 44) | |
| 左氧氟沙星 | 76 | 304 | 25 | (20, 30) | 38 | 185 | 21 | (15, 26) | |
| 复方新诺明 | 76 | 158 | 48 | (40, 56) | 21 | 88 | 24 | (15, 33) | |
| 复方磺胺甲噁唑 | 15 | 27 | 56 | (37, 74) | 3 | 18 | 17 | (-1, 34) | |
| 氨苄西林/舒巴坦 | 2 | 24 | 8 | (3, 19) | 2 | 12 | 17 | (-4, 38) | |
| 阿米卡星 | 21 | 118 | 18 | (11, 25) | 13 | 77 | 17 | (9, 25) | |
| 头孢西丁 | 81 | 142 | 57 | (49, 65) | 63 | 89 | 71 | (61, 80) | |
| 头孢唑林 | 107 | 142 | 75 | (68, 82) | 70 | 89 | 79 | (70, 87) | |
| 头孢呋辛 | 82 | 142 | 58 | (50, 66) | 61 | 89 | 69 | (59, 78) | |
| 头孢拉定 | 108 | 118 | 92 | (87, 97) | 73 | 77 | 95 | (90, 100) | |
| 头孢哌酮 | 66 | 118 | 56 | (47, 65) | 55 | 77 | 71 | (61, 82) | |
| 头孢他啶 | 60 | 118 | 51 | (42, 60) | 41 | 77 | 53 | (42, 64) | |
| 头孢吡肟 | 32 | 118 | 27 | (19, 35) | 27 | 77 | 35 | (24, 46) | |
| 苯唑西林 | 126 | 161 | 78 | (72, 85) | 23 | 96 | 24 | (15, 32) | |
| 注:A为耐药株数,B为总菌株数。 | |||||||||
本文对2篇文献[19, 24]中大肠埃希菌与一篇文献[24]中铜绿假单胞菌的总菌株数与耐药株数进行统计,并分别分析了这两种菌对抗生素的耐药率,研究中发现大肠埃希菌对氨苄西林的耐药率最高,为85% (95% CI为(0.73, 0.97)),对四环素耐药率最低,为8% (95% CI为(-0.07, 0.24));铜绿假单胞菌耐药率最高的抗生素也是氨苄西林,耐药率为94%(95% CI为(0.86, 1.00)),耐药率较低的抗生素为环丙沙星,耐药率为21%(95% CI为(0.07, 0.34))。具体数据如表 5所示。
| 抗生素 | 大肠埃希菌 | 铜绿假单胞菌 | |||||||
| A/株 | B/株 | 耐药率(%) | 95%CI(%) | A/株 | B/株 | 耐药率(%) | 95%CI(%) | ||
| 氨苄西林 | 28 | 33 | 85 | (73, 97) | 31 | 34 | 94 | (86, 100) | |
| 亚胺培南 | 17 | 21 | 81 | (64, 98) | 21 | 34 | 62 | (45, 78) | |
| 头孢唑林 | 26 | 33 | 79 | (65, 93) | 30 | 34 | 88 | (77, 99) | |
| 头孢呋辛 | 18 | 33 | 55 | (38, 72) | 25 | 34 | 74 | (59, 88) | |
| 头孢哌酮 | 9 | 21 | 43 | (22, 64) | 19 | 34 | 56 | (39, 73) | |
| 头孢他啶 | 13 | 33 | 39 | (23, 56) | 22 | 34 | 65 | (49, 81) | |
| 头孢曲松 | 19 | 33 | 58 | (41, 74) | 16 | 34 | 47 | (30, 64) | |
| 头孢噻肟 | 6 | 33 | 18 | (5, 31) | 10 | 34 | 29 | (14, 45) | |
| 左氧氟沙星 | 8 | 33 | 24 | (10, 39) | 20 | 34 | 59 | (42, 75) | |
| 环丙沙星 | 18 | 33 | 55 | (38, 72) | 7 | 34 | 21 | (7, 34) | |
| 阿米卡星 | 5 | 33 | 15 | (3, 27) | 9 | 34 | 26 | (12, 41) | |
| 丁胺卡那霉素 | 10 | 21 | 48 | (26, 69) | 18 | 34 | 53 | (36, 70) | |
| 庆大霉素 | 16 | 33 | 48 | (31, 66) | 29 | 34 | 85 | (73, 97) | |
| 妥布霉素 | 12 | 33 | 36 | (20, 53) | 15 | 34 | 44 | (27, 61) | |
| 复方新诺明 | 4 | 12 | 33 | (7, 60) | |||||
| 四环素 | 1 | 12 | 8 | (-7, 24) | |||||
| 头孢吡肟 | 2 | 12 | 17 | (-4, 38) | |||||
| 氨曲南 | 4 | 12 | 33 | (7, 60) | |||||
| 哌拉西林 | 2 | 12 | 17 | (-4, 38) | |||||
| 注:A为耐药株数,B为总菌株数。 | |||||||||
预防假体周围感染的关键在于严格的手术操作和术前准备。术前的彻底消毒和皮肤准备是预防感染的重要环节。此外,术中使用无菌操作和无菌器械,术后合理使用抗生素均是预防感染的重要措施。对于高危患者(如免疫功能低下、患有糖尿病等),须更加重视预防感染的措施[19]。一旦发生假体周围感染,早期诊断和积极治疗至关重要。治疗方案通常包括抗生素治疗和手术干预。手术干预可能包括清创手术、假体取出和再植入等。抗生素可以通过口服或静脉注射给予,具体的药物选择须根据感染的严重程度和病原体的敏感性来确定[26],因此,精准选择敏感抗生素是控制假体周围感染的有效途径。
本研究共纳入病原体样本4 338例,包括3 347株革兰氏阳性菌、775株革兰氏阴性菌、155株真菌以及61株分枝杆菌。本文的主要目的在于运用Meta分析方法,系统分析关节假体周围病原菌的分布情况和抗生素耐药性,并为未报告或培养结果呈阴性的PJI患者的临床治疗提供指导。
革兰氏阳性菌感染的患病率为76.0%,其中金黄色葡萄球菌是PJI患者检测出的最常见病原微生物,占所有病例的42.0%。其次是凝固酶阴性葡萄球菌(coagulase-negative staphylococcus,CONS),患病率约为39.2%。这与美国和中国台湾地区的研究结果相似,金黄色葡萄球菌也是这些地区最常见的致病微生物[30-31]。其他革兰氏阳性球菌,如肠球菌和链球菌,患病率较低。在台湾,金黄色葡萄球菌占假体周围感染病原菌感染的29.9%[32]。在德国,CONS是最常见的致病菌,占所有PJI病例的65.0%,研究也表明,耐甲氧西林的表皮葡萄球菌(methicillin-resistant Staphylococcus epidermidis,MRSE)在德国PJI患者中的比例在2012年已达到74.0%[33]。对于须进行关节置换手术的患者,积极预防CONS和金黄色葡萄球菌感染至关重要。一些当前耐药率较低的抗生素,如四环素、利福平、莫西沙星和氨苄西林/舒巴坦,可用于感染预防和治疗。
本研究发现,革兰氏阴性杆菌在病例中占比为17.8%,与文献报道的5%~20%范围基本一致[34-35]。在革兰氏阴性菌中,大肠埃希菌居主导地位,这与国内外相关研究结果相符。本研究发现,大肠埃希菌占革兰氏阴性菌病例的30.0%,其次是假单胞菌属,患病率为21.3%。大肠埃希菌和铜绿假单胞菌在文献中普遍表现出抗生素耐药性。在多种抗生素中,大肠埃希菌对四环素、头孢吡肟、哌拉西林和阿米卡星的耐药率较低,分别为8%、17%、17%和15%;铜绿假单胞菌对阿米卡星和环丙沙星的耐药率也相对较低,分别为26%和21%;此外,有文献报道,大肠埃希菌和铜绿假单胞菌对头孢哌酮/舒巴坦的耐药率低[24]。革兰氏阴性菌对抗生素的耐药程度较高,导致革兰氏阴性菌引起的感染易于反复发作,上述几种耐药率较低的抗生素可作为临床首选治疗药物。
本研究中,真菌感染占比3%,分枝杆菌占比2%。其中,白色念珠菌是引发假体周围感染最常见的真菌。研究中真菌和分枝杆菌感染比例有所增加,但差异并不显著。真菌性PJI的早期诊断较为困难,通常在疾病进展到中晚期时才被发现,这导致关节置换手术的失败率和复发率增加。相关文献报告指出,高达46%的培养阴性PJI是由真菌感染引起的,而43%则是由分枝杆菌引起的[36]。尽管分枝杆菌感染率很低,在2116例PJI中只有7例与之相关[37],但结核分枝杆菌引发的假体周围感染可以通过两阶段修复置换手术进行控制[38]。
然而,本研究也存在如下局限性。首先,纳入的分枝杆菌病例较少,可能对分布和发病率的结果产生影响,因此未来应增加样本量,以减少由于数据不足导致的结果偏倚。其次,某些参考文献的数据量较大,在分析时可能会产生偏倚,因此未来应努力平衡样本权重。最后,纳入研究的地理来源存在差异,可能会影响统计结果的可靠性。
大多数假体周围感染是由凝固酶阴性葡萄球菌和金黄色葡萄球菌引起,并有多种敏感抗生素可供选择。尽管引发假体周围感染的革兰氏阴性菌表现出普遍的抗生素耐药性,仍存在一些具有较高敏感性的抗生素作为治疗选择,但抗生素的选择和使用受多种因素影响,不仅仅是耐药率,还包括抗生素的选择和持续时间、手术清创步骤、抗生素给药类型(关节内、局部、静脉内注射给药以及长期口服)、初次和翻修手术对比、髋关节和膝关节对比、感染微生物以及治疗成功或失败的定义[39]。
细菌对抗生素产生耐药性是临床抗生素使用不可避免的后果。在众多抗生素的选择中,限制不必要的抗生素使用、强调早期微生物学诊断、加强感染预防干预、优化当前抗生素使用方案,并探索新的药物靶点,这些措施对于延缓耐药性的蔓延和改善假体周围感染的治疗效果具有重要意义。
| [1] |
Shahi A, Tan TL, Chen AF, Maltenfort MG, Parvizi J. In-hospital mortality in patients with periprosthetic joint infection[J]. J Arthroplasty, 2017, 32(3): 948-952.e1.
[DOI]
|
| [2] |
Tande AJ, Patel R. Prosthetic joint infection[J]. Clin Microbiol Rev, 2014, 27(2): 302-345.
[DOI]
|
| [3] |
Fernández-Sampedro M, Fariñas-Alvarez C, Garces-Zarzalejo C, Alonso-Aguirre MA, Salas-Venero C, Martínez-Martínez L, Fariñas MC. Accuracy of different diagnostic tests for early, delayed and late prosthetic joint infection[J]. BMC Infect Dis, 2017, 17(1): 592.
[DOI]
|
| [4] |
Ahmad SS, Shaker A, Saffarini M, Chen AF, Hirschmann MT, Kohl S. Accuracy of diagnostic tests for prosthetic joint infection: a systematic review[J]. Knee Surg Sports Traumatol Arthrosc, 2016, 24(10): 3064-3074.
[DOI]
|
| [5] |
陈洁, 张先龙, 余永胜, 臧国庆, 奚敏. 影响膝关节假体周围感染再置换术预后的相关因素[J]. 中华传染病杂志, 2016, 34(08): 469-74. [DOI]
|
| [6] |
彭慧明, 王龙超, 陈继营, 周一新, 田华, 林剑浩, 郭万首, 曲铁兵, 郭艾, 曹永平, 翁习生. 2014—2016年北京市9家医院人工髋膝关节置换术后假体周围感染患者微生物学的多中心调查研究[J]. 中华外科杂志, 2019, 57(8): 596-600. [DOI]
|
| [7] |
周历程, 李国庆, 胥伯勇, 阿斯哈尔江·买买提明, 曹力, 张晓岗. 急性、迟发性和慢性假体周围感染的病原菌分布及耐药性分析[J]. 中华外科杂志, 2021, 59(6): 484-490. [DOI]
|
| [8] |
张理昂, 周一新, 李玉军, 徐辉, 周乙雄. 髋关节置换术后假体周围感染的治疗[J]. 中华骨科杂志, 2009(10): 924-928. [DOI]
|
| [9] |
彭慧明, 翁习生, 翟吉良, 边焱焱, 林进, 金今, 钱文伟, 赵丽娟. 初次人工全膝关节置换术后假体周围感染的微生物学及药敏分析[J]. 中华外科杂志, 2013(5): 413-416. [DOI]
|
| [10] |
唐旭, 王启, 王辉, 王胜锋, 钟群杰, 李志昌, 柯岩, 李儒军, 李虎, 林剑浩. 人工关节置换术后假体周围感染诊断方法的比较与评价[J]. 中华外科杂志, 2016, 54(4): 251-257. [DOI]
|
| [11] |
穆文博, 胥伯勇, 郭文涛, 张晓岗, 纪保超, 阿斯哈尔江·买买提明, 曹力. 保留假体的清创术治疗初次关节置换术后早期假体周围感染[J]. 中华骨科杂志, 2019(7): 398-405. [DOI]
|
| [12] |
黄子达, 张翀景, 李文波, 方心俞, 张超凡, 杨滨, 李孟庆, 林建华, 张文明. 宏基因组二代测序技术检测病原菌在诊断假体周围感染中的作用[J]. 中华骨科杂志, 2019(15): 944-53. [DOI]
|
| [13] |
张泽宇, 王启金, 白国昌, 方心俞, 黄子达, 张超凡, 李文波, 蔡渊卿, 张文明. 假体周围感染翻修术前预防性应用抗生素对术中标本培养阳性率的影响研究[J]. 中华创伤骨科杂志, 2021, 23(5): 395-400. [DOI]
|
| [14] |
杨云建, 杨帆, 张振东, 李恒, 陈继营. 初次人工全膝关节置换术后假体周围感染的病原菌分布及药敏分析[J]. 中国修复重建外科杂志, 2014, 28(07): 848-852. [DOI]
|
| [15] |
周一逸, 刘仪, 袁鹏, 冯德宏, 杨正杰. 骨关节置换术后假体周围感染的病原菌特征及影响因素分析[J]. 中华医院感染学杂志, 2019, 29(14): 2189-2193. [DOI]
|
| [16] |
闫开成, 王昆, 胡锦桃, 张卓辉, 刘浩, 蔡芸. 关节置换术后假体周围感染病原菌分布特点及治疗[J]. 中国感染控制杂志, 2022, 21(6): 546-553. [DOI]
|
| [17] |
何家伟, 汪洋, 纪保超, 杨建华. 关节置换术后假体周围感染的病原菌分布及药敏分析[J]. 西北药学杂志, 2021, 36(5): 837-843. [DOI]
|
| [18] |
陈志, 周宗科, 沈彬, 杨静, 康鹏德, 裴福兴. 急性、迟发性、慢性假体周围感染的病原学特征及疗效分析[J]. 实用骨科杂志, 2019, 25(4): 313-316. |
| [19] |
江旭, 曹福洋, 熊翱, 杨猛, 谭俊, 于洋, 张少坤, 许建中. 假体周围感染102例病原菌分布、耐药及临床特征的差异分析[J]. 中国组织工程研究, 2022, 26(36): 5837-5843. [DOI]
|
| [20] |
王瑛, 常军林. 髋关节置换术后假体周围感染的病原菌分布及耐药性分析[J]. 海南医学, 2022, 33(12): 1577-1579. [DOI]
|
| [21] |
陈志, 林佳俊, 刘文革, 周宗科, 沈彬, 杨静, 康鹏德, 裴福兴. 髋膝关节置换术后假体周围感染病原菌分布与耐药性变化趋势分析[J]. 中国骨伤, 2020, 33(11): 1032-1036. [DOI]
|
| [22] |
崔苛苛, 杨伟毅, 刘军, 潘建科, 张葆青, 曹学伟. 全膝关节置换后假体周围感染病原菌分布特点及治疗策略[J]. 中国组织工程研究, 2017, 21(35): 5721-5726. [DOI]
|
| [23] |
徐倩, 刘玥, 李丹华. 人工关节置换术后假体周围感染病原菌分布及耐药性分析[J]. 检验医学与临床, 2020, 17(13): 1854-1856. [DOI]
|
| [24] |
王娜, 李少侠, 曹娜娜, 赵琳. 人工关节置换术后假体周围感染的病原菌分布及耐药性分析[J]. 河南医学研究, 2020, 29(24): 4436-4439. [DOI]
|
| [25] |
陈仁德, 李勇军, 李向平, 陈婧, 张莎莎, 王新. 人工关节置换术后假体周围组织感染的病原菌分布及耐药性分析[J]. 中国骨与关节损伤杂志, 2019, 34(10): 1022-1025. [DOI]
|
| [26] |
Karczewski D, Müllner M, Hipfl C, Perka C, Müller M. Two-stage exchange for PJI with co-existing cerclages for fracture: higher rates of early re-infections and difficult to treat microbes[J]. Arch Orthop Trauma Surg, 2023, 143(4): 1793-1798.
[DOI]
|
| [27] |
Holleyman RJ, Baker PN, Charlett A, Gould K, Deehan DJ. Analysis of causative microorganism in 248 primary hip arthroplasties revised for infection: a study using the NJR dataset[J]. Hip Int, 2016, 26(1): 82-89.
[URI]
|
| [28] |
Preobrazhensky P, Bozhkova S, Kochish A, Tikhilov R, Kazemirsky A. Comparative analysis of pathogen structure in patients with PJI after primary total hip and knee arthroplasty[J]. Arch Orthop Trauma Surg, 2021, 141(11): 1963-1969.
[DOI]
|
| [29] |
Klement MR, Cunningham DJ, Wooster BM, Wellman SS, Bolognesi MP, Green CL, Garrigues GE. Comparing standard versus extended culture duration in acute hip and knee periprosthetic joint infection[J]. J Am Acad Orthop Surg, 2019, 27(9): e437-e443.
[DOI]
|
| [30] |
Aggarwal VK, Bakhshi H, Ecker NU, Parvizi J, Gehrke T, Kendoff D. Organism profile in periprosthetic joint infection: pathogens differ at two arthroplasty infection referral centers in Europe and in the United States[J]. J Knee Surg, 2014, 27(5): 399-406.
[URI]
|
| [31] |
Tsai Y, Chang CH, Lin YC, Lee SH, Hsieh PH, Chang Y. Different microbiological profiles between hip and knee prosthetic joint infections[J]. J Orthop Surg (Hong Kong), 2019, 27(2): 2309499019847768.
[DOI]
|
| [32] |
Tsai JC, Sheng WH, Lo WY, Jiang CC, Chang SC. Clinical characteristics, microbiology, and outcomes of prosthetic joint infection in Taiwan[J]. J Microbiol Immunol Infect, 2015, 48(2): 198-204.
[DOI]
|
| [33] |
Zajonz D, Wuthe L, Rodloff AC, Prietzel T, von Salis-Soglio GF, Roth A, Heyde CE, Josten C, Ghanem M. Infektionen von Hüft-und Knieendoprothesen. Erregerspektrum und die Rolle multiresistenter Bakterien[Infections of hip and knee endoprostheses. Spectrum of pathogens and the role of multiresistant bacteria][J]. Chirurg, 2016, 87(4): 332-339.
[URI]
|
| [34] |
Kandel CE, Jenkinson R, Daneman N, Backstein D, Hansen BE, Muller MP, Katz KC, Widdifield J, Bogoch E, Ward S, Sajja A, Jeldes FG, McGeer A. Predictors of treatment failure for hip and knee prosthetic joint infections in the setting of 1-and 2-stage exchange arthroplasty: a multicenter retrospective cohort[J]. Open Forum Infect Dis, 2019, 6(11): ofz452.
[DOI]
|
| [35] |
Kavolus JJ, Cunningham DJ, Rao SR, Wellman SS, Seyler TM. Polymicrobial infections in hip arthroplasty: lower treatment success rate, increased surgery, and longer hospitalization[J]. J Arthroplasty, 2019, 34(4): 710-716.e3.
[URI]
|
| [36] |
Million M, Bellevegue L, Labussiere AS, Dekel M, Ferry T, Deroche P, Socolovschi C, Cammilleri S, Raoult D. Culture-negative prosthetic joint arthritis related to Coxiella burnetii[J]. Am J Med, 2014, 127(8): 786.e7-786.e10.
[DOI]
|
| [37] |
Berbari EF, Hanssen AD, Duffy MC, Steckelberg JM, Osmon DR. Prosthetic joint infection due to Mycobacterium tuberculosis: a case series and review of the literature[J]. Am J Orthop (Belle Mead NJ), 1998, 27(3): 219-227.
[URI]
|
| [38] |
Van Le T, Duong TB, Hien KQ, Ton QNQ, Huyn T, Binh TP, Tu DT, Tho PP, Binh LN, Hau HP, Hung TNK. Two-stage revision for treatment of tuberculous prosthetic hip infection: an outcome analysis[J]. Eur J Orthop Surg Traumatol, 2023, 33(3): 645-651.
[DOI]
|
| [39] |
Myers TG, Lipof JS, Chen AF, Ricciardi BF. Antibiotic stewardship for total joint arthroplasty in 2020[J]. J Am Acad Orthop Surg, 2020, 28(18): e793-e802.
[DOI]
|
 2024, Vol. 19
2024, Vol. 19


