2. 复旦大学附属公共卫生临床中心检验科, 上海 201508
2. Department of Medical Laboratory, Shanghai Public Health Clinical Center, Fudan University, Shanghai 201508, China
准确界定慢性乙型肝炎病毒(hepatitis B virus, HBV)感染的自然史分期不仅是有效管理患者、合理选用药物的前提,也是有效开展实验研究、合理构建科学理论的基石。慢性HBV感染可分为4个连续的自然史分期[1-5],依次为HBV e抗原(hepatitis B e antigen, HBeAg)阳性非活动性肝炎(non-aggressive/inactive hepatitis, NAH)和活动性肝炎(aggressive/active hepatitis, AH)及HBeAg阴性NAH和AH。HBeAg阳性NAH以持续性肝脏轻微坏死性炎症和没有或仅有轻微纤维化为特征,在不同患者和同一患者不同时点之间高度一致; HBeAg阳性AH表现为持续或反复发生的肝脏侵袭性坏死性炎症和进展性纤维化,在不同患者和同一患者不同时点之间高度离散; HBeAg阴性NAH以持续性肝脏轻微坏死性炎症和退缩性纤维化为特征,仅坏死性炎症在不同患者和同一患者不同时点之间高度一致; HBeAg阴性AH表现为持续或反复发生的肝脏侵袭性坏死性炎症和进展性纤维化,在不同患者和同一患者不同时点之间高度离散。
界定慢性HBV感染自然史分期的标准仍未统一[1-4]。肝脏病理学参数是界定自然史分期的一套关键指标[1-4]。但是,动态监测病理学参数在临床研究和实践中并不可行,能有效反映肝脏轻微病变的无创实验室指标非常有限。血清丙氨酸转氨酶(alanine transaminase, ALT)已被推荐用于自然史分期的划分,然而,其功能截断值(functional cutoff)还未达成一致[1-4]; 而且,ALT的正常参考值上限(upper limit of normal, ULN)一直存在争议和讨论[6]。亚太肝病学会(The Asian Pacific Association for the Study of the Liver, APASL)2015[1]、欧洲肝病学会(The European Association for the Study of the Liver, EASL)2017[2]、美国肝病学会(Association for the Study of Liver Diseases, AASLD) 2018[3]和中华医学会肝病和感染病分会(The Chinese Society of Hepatology and Chinese Society of Infectious Diseases, CSH/CSID)2022指南[4]均采用了存在争议的ALT的ULN作为HBeAg阳性和阴性NAH的识别标准,其中,APASL 2015和EASL 2017指南推荐ALT≤40 IU/L、AASLD 2018指南推荐ALT≤35 IU/L(男)和ALT≤25 IU/L(女)作为ULN,而CSH/CSID 2022指南则对ALT的ULN无明确推荐。
血清病毒学参数是界定自然史分期的另一套必备指标[1-4]。就HBeAg阳性感染而言,肝脏轻微病变并不全见于NAH,也可少见于AH; 就HBeAg阳性AH而言,肝脏轻微病变可持续存在,也可间歇发生[7]。但是,HBeAg阳性NAH以高水平HBV复制为特征,而HBeAg阳性NAH向HBeAg阳性AH过渡和HBeAg阳性AH分别表现为高到中和低到中水平HBV复制[7]; HBeAg阴性NAH以低水平HBV复制为特征,而HBeAg阴性AH表现为低到中水平HBV复制。血清HBV DNA[1-4]和HBV表面抗原(hepatitis B surface antigen, HBsAg)已被推荐用于自然史分期的划分[4],然而,它们的功能截断值仍未达成共识。EASL 2017、AASLD 2018和CSH/CSID 2022指南分别推荐HBV DNA>7.000 log10 IU/mL、HBV DNA>6.000 log10 IU/mL和HBV DNA>7.301 log10 IU/mL作为识别HBeAg阳性NAH的标准[2-4],而APASL 2015指南[1]则对HBV DNA识别HBeAg阳性NAH的标准无明确推荐; EASL 2017和AASLD 2018指南均推荐HBV DNA≤3.301 log10 IU/mL作为识别HBeAg阴性NAH的标准[2-3],而APASL 2015和CSH/CSID 2022指南则对HBV DNA识别HBeAg阴性NAH的标准无明确推荐[1, 4]。只有CSH/CSID 2022指南[4]对HBsAg识别HBeAg阳性和阴性NAH的标准给予了明确推荐,分别为HBsAg>4.000 log10 IU/mL和HBsAg≤3.000 log10 IU/mL。
关于ALT和HBV复制标记物,如HBsAg、HBeAg、HBV核心相关抗原(hepatitis B core-related antigen, HBcrAg)及HBV DNA、HBV RNA划分自然史分期的性能评价,已有多篇文献进行报道和总结,但多采用横向设计,并且几乎均参照存在争议的界定自然史分期的标准[8-14]; 仅少数涉及纵向设计,而且,纵向研究的主要发现也不完全一致[15-16]。HBeAg血清转换(HBeAg seroconversion, ESC)是慢性HBV感染自然史的一个标志性事件,预示HBeAg阳性AH的终结或HBeAg阴性NAH的肇始。HBeAg阳性NAH的终结或HBeAg阳性AH的肇始是HBeAg阳性患者将来可能发生ESC的前奏。因此,ESC作为HBeAg阳性AH的一个终点事件,也是基于纵向设计评价ALT或HBV复制标记物界定HBeAg阳性NAH与HBeAg阳性AH的一个基础标准。
本文根据179例HBeAg阳性慢性HBV感染患者的长期随访队列,以自发性ESC作为终点事件,基于受试者工作特征(receiver operating characteristic, ROC)曲线和Kaplan-Meier生存分析,优选了基线ALT及HBV复制标记物HBsAg、HBeAg和HBV DNA预测未来发生ESC的功能截断值; 在此基础上,评价了基于功能截断值的ALT串联HBsAg、HBeAg和HBV DNA识别HBeAg阳性NAH的性能。
1 资料与方法 1.1 研究对象选取2011年8月—2020年6月,累计182例在上海市公共卫生临床中心首次就诊、不愿接受抗病毒治疗但同意接受定期随访的HBeAg阳性慢性HBV感染患者。在随访期间,要求患者每3~6个月回访一次并进行实验室和超声检查。实验室检查至少包括全血细胞分析及血清生化、HBV复制标志物(HBsAg、HBeAg和HBV DNA)和甲胎蛋白。如果ALT持续高于40 IU/L或间歇高于80 IU/L超过2年,建议患者进行肝活检或接受抗病毒治疗。一旦ALT高于250 IU/L或总胆红素高于34.2 μmol/L,建议患者每1~2个月回访一次,或进行肝活检或接受抗病毒治疗。一旦血小板计数少于100×109/L或超声检查提示肝硬化,建议患者进行肝活检或接受抗病毒治疗。在未能实现ESC且仍不愿接受抗病毒治疗的情况下,如果肝活检显示显著坏死性炎症(病理学分级≥G2,基于Scheuer标准)或显著纤维化(病理学分期≥S2,基于Scheuer标准)和严重坏死性炎症(病理学分级≥G3)或广泛纤维化(病理学分期≥S3),则建议患者分别每2年和每年进行一次重复肝活检。所有患者接受了至少2次肝活检。
通过医院信息系统(hospital information system)和实验室信息系统(laboratory information system)中回顾性收集每例患者的人口学、实验室和病理学数据。患者的随访起点被定义为首次就诊或首次进行肝活检的日期。所有患者在随访起点均未合并其他嗜肝病毒(甲型、丙型、丁型和戊型肝炎病毒)或人类免疫缺陷病毒感染以及活动性Epstein-Barr病毒或巨细胞病毒感染,均未合并脂肪性肝病、酒精性肝病、中毒性或药物性肝损害、遗传性肝病,或胆囊或胆管结石; 随访起点前6个月之内任何时候均未接受过核苷(酸)类或干扰素-α类抗病毒治疗; 随访起点前6个月之外任何时候均未接受过超过6个月的核苷(酸)类或超过3个月的干扰素-α类抗病毒治疗。3例患者因随访起点关键实验室数据不完整被排除。
数据收集的截止日期为2022年1月31日。经排除后,由179例患者组成的完整队列被纳入分析。其中,77例患者在随访期间出现了ESC,归入ESC亚队列,随访终点被定义为首次出现自发性ESC的日期。其余102例患者在随访期间未出现ESC,归入无ESC亚队列,其中:18例接受了核苷(酸)类抗病毒治疗,随访终点被定义为抗病毒治疗之前最后一次随访的日期; 84例至数据收集截止之日仍未回访,随访终点被定义为数据收集截止之前最后一次随访的日期。
1.2 伦理学审查本研究得到了上海市公共卫生临床中心独立伦理委员会的批准(批准编号: 2013-K-008, 2018-S003-002,2023-S014-01)。所有患者在每次肝活检前均签署了有创检查书面知情同意书,同意剩余肝组织和血清标本及病理学和实验室数据可用于并且仅用于科学研究。所有临床决策均符合赫尔辛基宣言(2013版)提出的伦理原则。
1.3 实验室检查血清HBsAg和HBeAg使用Abbott Architect i2000全自动免疫分析系统及其配套试剂检测[7, 17]。HBsAg的线性范围为0.05~250 IU/mL,如HBsAg高于检测上限,则将血清稀释500倍后重新检测; HBeAg的检测下限为1.0 SCO。2015年8月之前,血清HBV DNA采用染料法定量PCR (quantitative polymerase chain reaction, qPCR)和使用Bio-Rad Icycler PCR系统检测,试剂购自深圳凯杰生物工程有限公司,检测范围为500~5×107 IU/mL[7, 17]; 2015年8月之后,血清HBV DNA采用探针法qPCR和使用Roche LightCycler 480 qPCR system系统检测,试剂购自湖南圣湘生物科技有限公司,检测范围为100~2×109 IU/mL[7, 17]。2015年8月之前,血清ALT使用Hitachi 7600全自动生化分析仪及其配套试剂检测; 2015年8月之后,血清ALT使用Architect c16000全自动生化分析仪及其配套试剂检测。
1.4 病理学诊断采用超声引导下的经皮抽吸式肝活检采集肝组织,活检针型号为16G。活检标本采集后直接放入预先准备好的塑料管中,速冻送检。活检标本由病理学专职人员在36 h内处理。活检标本的质量评价和病理学诊断由一名资深病理学医师独立进行。肝脏病理学诊断参照Scheuer评分系统[18],其中,病理学分级(grade, G)是对坏死性炎症程度的描述,分G0~G4五级; 病理学分期(stage, S)是对纤维化和架构改变程度的描述,分S0~S4五期。本研究将病理学分级≤G1和分期≤S1分别定义为轻微坏死性炎症和轻微纤维化; 将病理学分级≥G2、≥G3和≥G4分别定义为显著、严重和凶危型坏死性炎症,将病理学分期≥S2、≥S3和≥S4分别定义为显著、广泛和结节性纤维化(cirrhotic fibrosis)。
1.5 统计学方法统计分析和图形制作采用MedCalc 15.8(MedCalc Software, Mariakerke, Belgium)。ESC亚队列与无ESC亚队列基线ALT和HBV复制标志物之间的差异比较采用独立样本Mann-Whitney U检验。ESC亚队列与无ESC亚队列基线肝脏病理学分级和分期之间的差异比较采用Cochran-Armitage卡方趋势检验。ESC亚队列与无ESC亚队列基线肝脏轻微坏死性炎症、轻微纤维化及“轻微坏死性炎症和轻微纤维化”构成比之间的差异比较采用Pearson卡方检验。基线ALT和HBV复制标志物预测自发性ESC的功能截断值的确定采用ROC曲线分析序贯Kaplan-Meier生存分析:根据ROC曲线分析,确定基线ALT和HBV复制标志物预测自发性ESC的折中截断值(tradeoff cutoff); 以折中截断值为基准,选择多个便于应用的有序截断值; 基于多个有序截断值进行二元分组患者的无ESC生存曲线之间的差异比较采用Log rank检验; 参照Log rank检验的结果,优选预测自发性ESC的功能截断值。以功能截断值为标准,较低水平基线ALT串联较高水平基线HBV复制标志物患者与较高水平基线ALT并联较低水平基线HBV复制标志物患者的基线肝脏病理状态的构成比之间的差异比较,采用Pearson卡方检验或Fisher精确检验。P < 0.05则被认为差异有统计学意义; Kaplan-Meier生存分析中,二元分组患者随访期间某固定时间点生存概率的95%可信区间(95% confidence interval, 95%CI)的不重叠也被认为差异有统计学意义。
2 结果 2.1 ESC亚队列和无ESC亚队列患者的基线特征和随访时间ESC亚队列和无ESC亚队列患者的人口学、实验室检测和病理学检测的基线(随访起点)数据及其差异比较如表 1所示。经过比较发现,基线ALT、HBV复制标志物和患者肝脏的病理状态可能是预测自发性ESC的可用参数。
| Variable | ESC sub-cohort | ESC-free sub-cohort | χ2/ Z | P | |||
| N | Summary statistics | N | Summary statistics | ||||
| Female, n (%) | 77 | 39 (50.6) | 102 | 48 (47.1) | 0.225a | 0.635 1 | |
| Age (years), Md (IQR) | 77 | 30.00 (27.00~35.00) | 102 | 32.00 (28.00~38.00) | 2.246b | 0.024 7 | |
| ALT (IU/L), Md (IQR) | 77 | 101.00 (58.00~200.50) | 102 | 54.00 (31.00~121.00) | 3.295b | 0.001 0 | |
| HBsAg (log10 IU/mL), Md (IQR) | 77 | 4.138 (3.657~4.509) | 102 | 4.439 (3.843~4.717) | 2.201b | 0.027 7 | |
| HBeAg (log10 SCO), Md (IQR) | 77 | 2.787 (1.632~3.113) | 102 | 3.077 (2.660~3.164) | 3.285b | 0.001 0 | |
| HBV DNA (log10 IU/mL), Md (IQR) | 77 | 7.324 (6.556~7.699) | 102 | 7.632 (6.869~7.699) | 2.209b | 0.027 2 | |
| Pathological grade (G0:G1:G2:G3:G4) | 71 | 0:42:23:6:0 | 93 | 0:69:24:0:0 | 7.319c | 0.006 8 | |
| Pathological stage (S0:S1:S2:S3:S4) | 71 | 1:30:28:4:8 | 93 | 0:53:34:4:2 | 5.683c | 0.017 1 | |
| Pathological grade≤G1, n (%) | 71 | 42 (59.2) | 93 | 69(74.2) | 4.138a | 0.041 9 | |
| Pathological stage≤S1, n (%) | 71 | 31(43.7) | 93 | 53(57.0) | 2.845a | 0.091 7 | |
| Pathological grade≤G1 and stage≤ S1, n (%) | 71 | 28 (39.4) | 93 | 51 (54.8) | 3.802a | 0.051 2 | |
| ALT:alanine aminotransferase; HBsAg:hepatitis B surface antigen; HBeAg:hepatitis B e antigen; HBV DNA:hepatitis B virus DNA; ESC:HBeAg seroconversion; Md (IQR):median (interquartile range); log10:logarithmic number with base 10.
aPearson chi-square test; bMann-Whitney U test; cCochran-Armitage chi-square test for trend. | |||||||
完整队列179例患者随访时间的全距为1.0~112.0个月,中位值(median, Md)[四分位距(interquartile range, IQR)]为42.0(24.0~68.0)个月。其中,ESC亚队列77例患者随访时间的全距为1.0~90.0个月,Md(IQR)为29.0(20.0~49.0)个月; 无ESC亚队列102例患者随访时间的全距为10.0~112.0个月,Md(IQR)为50.5(33.0~78.0)个月。
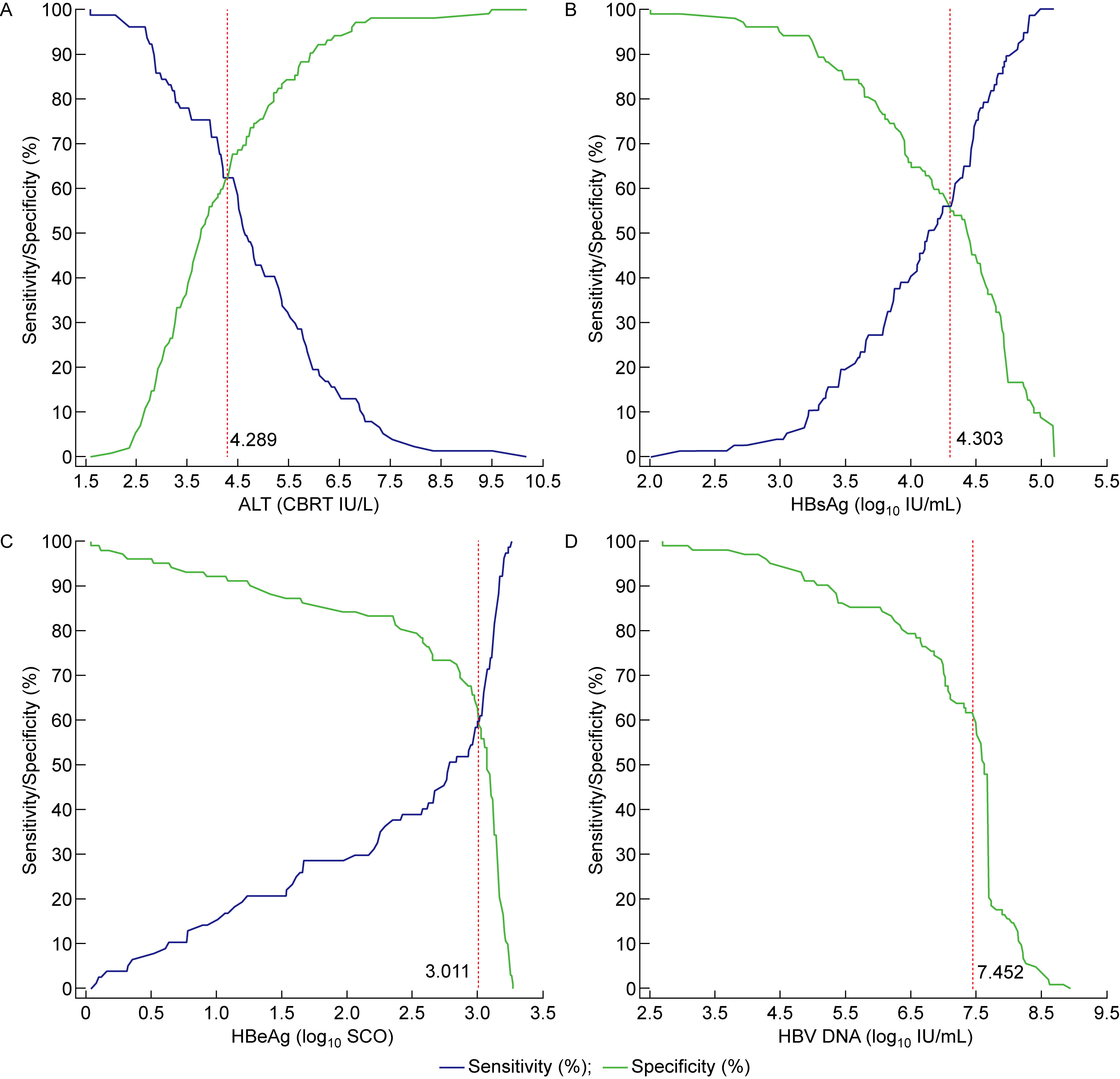
2.2 基线ALT和HBV复制标志物预测ESC的功能截断值以ESC作为状态变量进行ROC曲线分析,获得与基线ALT和HBV复制标志物的每个实测值相对应的预测ESC的灵敏度和特异度。然后,绘制实测值与灵敏度和特异度的关系图; 根据图中灵敏度与特异度的相交点,标定折中截断值。基线ALT和HBV复制标志物的实测值与其预测ESC的灵敏度和特异度的关系如图 1所示。
|
|
A, B, C and D: plots of measured values of baseline ALT, HBsAg, HBeAg and HBV DNA against their sensitivity (%) and specificity (%) in predicting ESC, respectively. ALT: alanine aminotransferase; HBsAg: hepatitis B surface antigen; HBeAg: hepatitis B e antigen; HBV DNA: hepatitis B virus DNA; ESC: HBeAg seroconversion; CBRT: cubic root; log10: logarithmic number with base 10.
The red dotted lines are the vertical lines through the intersection of sensitivity and specificity used to mark the tradeoff cutoffs. The tradeoff cutoffs in predicting ESC, ALT>78.90 IU/L, HBsAg≤4.303 log10 IU/mL, HBeAg≤3.011 log10 SCO and HBV DNA≤7.452 log10 IU/mL. 图 1 基线ALT和HBV复制标志物的实测值与其预测ESC的灵敏度和特异度的关系 Fig. 1 Plots of measured values of baseline ALT and HBV replication markers against their sensitivity and specificity in predicting ESC |
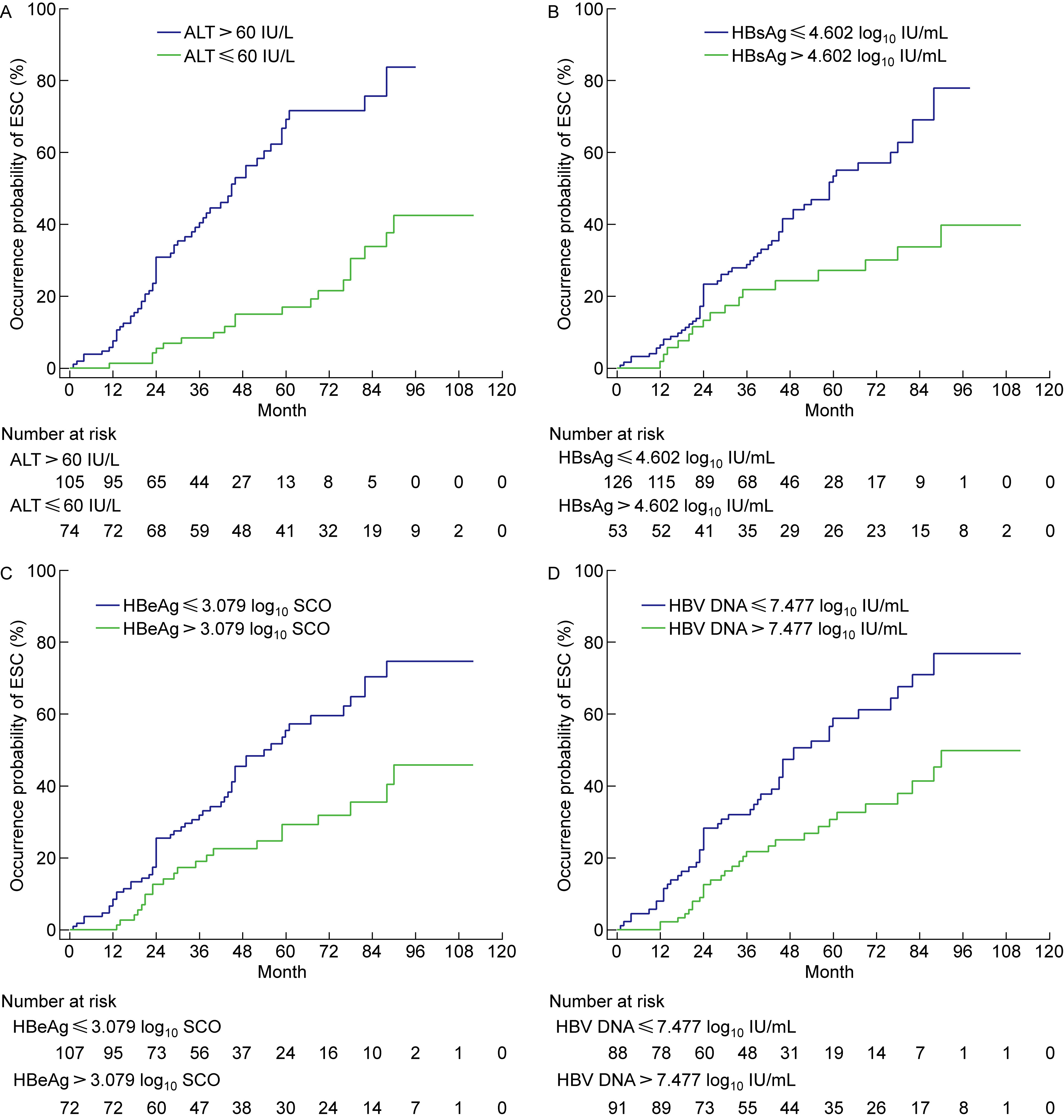
以基线ALT和HBV复制标志物预测ESC的折中截断值为基准,按照预测ESC的灵敏度的递升顺序,选择至少3个便于应用的有序截断值; 其中之一等于或近似等于折中截断值。然后,以多个有序截断值作为分组依据,依次进行二元分组; 再以二元分组作为因素变量,依次进行Kaplan-Meier生存分析。根据多个二元分组患者生存曲线之间统计学差异中的最显著差异,指定功能截断值。根据基线ALT和HBV复制标志物预测ESC的功能截断值进行二元分组患者的无ESC生存曲线如图 2所示。
|
|
A, B, C, and D: ESC-free survival curves for patients binary grouped according to functional cutoffs for baseline ALT, HBsAg, HBeAg, and HBV DNA in predicting ESC, respectively.
ALT: alanine aminotransferase; HBsAg: hepatitis B surface antigen; HBeAg: hepatitis B e antigen; HBV DNA: hepatitis B virus DNA; ESC: HBeAg seroconversion; log10: logarithmic number with base 10. Comparison of the differences between the survival curves of the two groups of patients (based on Log rank test), ALT>60.00 versus ALT≤60 IU/L, χ2=34.565 7, P < 0.000 1;HBsAg≤4.602 log10 IU/mL versus HBsAg>4.602 log10 IU/mL, χ2=9.677 5, P=0.001 9;HBeAg≤3.079 log10 SCO versus HBeAg>3.079 log10 SCO, χ2 = 10.967 0, P=0.000 9;HBV DNA≤7.477 log10 IU/mL versus HBV DNA>7.477 log10 IU/mL, χ2=11.859 0, P=0.000 6. 图 2 根据基线ALT和HBV复制标志物预测ESC的功能截断值进行二元分组的患者的Kaplan-Meier无ESC生存曲线 Fig. 2 Kaplan-Meier ESC-free survival curves for patients binary grouped by the functional cutoffs of baseline ALT and HBV replication markers in predicting ESC |
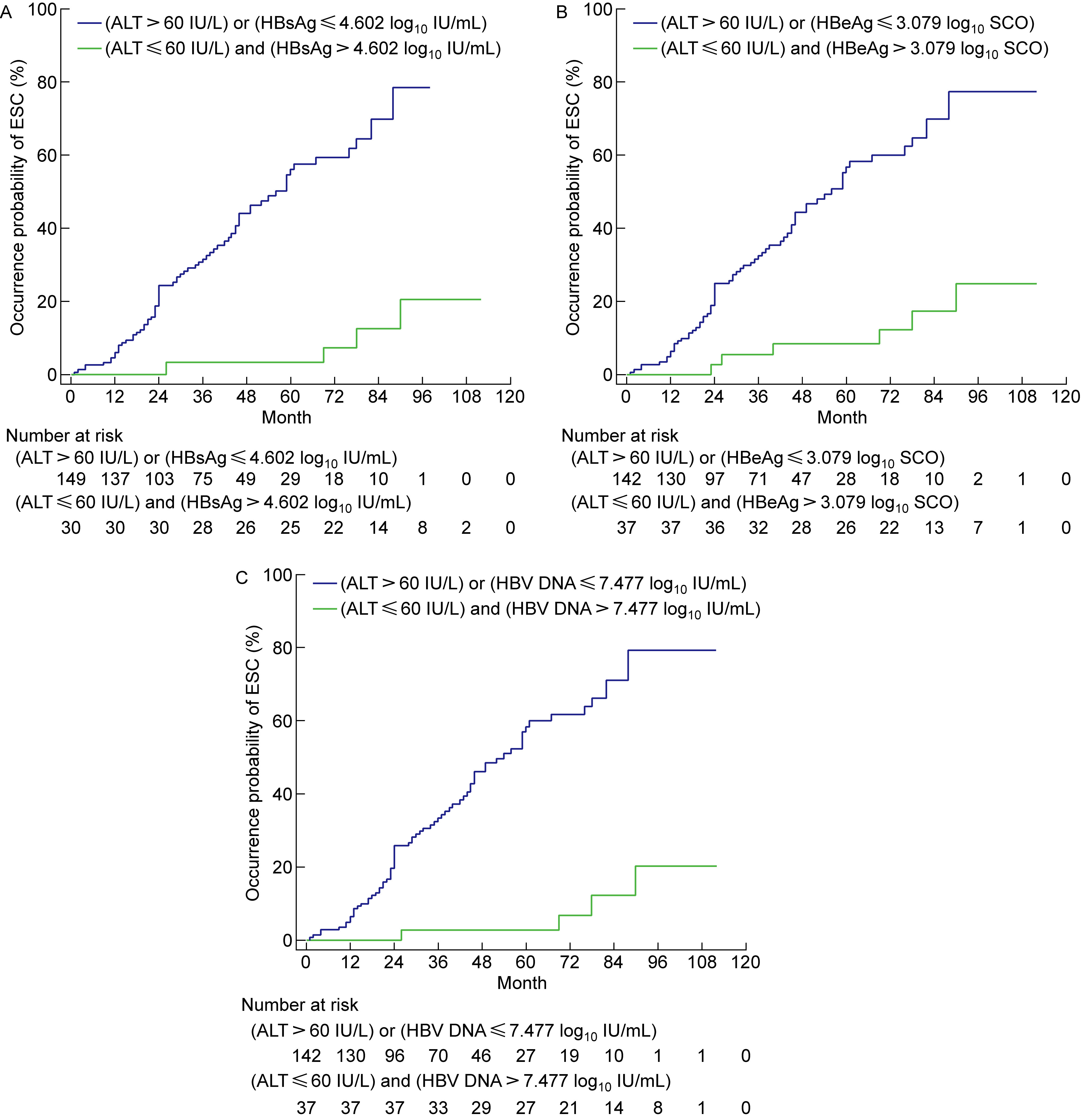
以预测ESC的功能截断值作为分组依据,较低水平基线ALT串联较高水平基线HBV复制标志物患者和较高水平基线ALT并联较低水平基线HBV复制标志物患者的无ESC生存曲线如图 3所示; 两组患者随访前6年各固定时间点的无ESC生存概率及其差异比较如表 2所示。至数据收集截止日期,较低水平基线ALT串联较高水平基线HBsAg、HBeAg、HBV DNA患者和较高水平基线ALT并联较低水平基线HBsAg、HBeAg、HBV DNA患者发生ESC的频率分别为13.3%(4/30)和49.0%(73/149)、16.2%(6/37)和50.0%(71/142)、10.8%(4/37)和51.4% (73/142)。
|
|
A, B, and C: ESC-free survival curves for patients with lower levels of baseline ALT in tandem with higher levels of baseline HBsAg, HBeAg, and HBV DNA and for patients with higher levels of baseline ALT in parallel with lower levels of baseline HBsAg, HBeAg, and HBV DNA, respectively. ALT: alanine aminotransferase; HBsAg: hepatitis B surface antigen; HBeAg: hepatitis B e antigen; HBV DNA: hepatitis B virus DNA; ESC: HBeAg seroconversion; log10: logarithmic number with base 10.
Comparison of the differences between the survival curves of the two groups of patients (based on Log rank test), ALT>60 IU/L in parallel with HBsAg≤4.602 log10 IU/mL versus ALT≤60 IU/L in tandem with HBsAg>4.602 log10 IU/mL, χ2=24.246 6, P < 0.000 1;ALT>60 IU/L in parallel with HBeAg≤3.079 log10 SCO versus ALT≤60 IU/L in tandem with HBeAg>3.079 log10 SCO, χ2=22.798 9, P < 0.000 1;ALT>60 IU/L in parallel with HBV DNA≤7.477 log10 IU/mL versus ALT≤60 IU/L in tandem with HBV DNA>7.477 log10 IU/mL, χ2=29.158 6, P < 0.000 1. Risk ratio (95% confidence interval) for ESC in both groups [RR (95% CI)], ALT> 60 IU/L in parallel with HBsAg≤4.602 log10 IU/mL versus ALT≤60 IU/L in tandem with HBsAg>4.602 log10 IU/mL, 7.610 7 (4.661 9 to 12.424 6);ALT>60 IU/L in parallel with HBeAg≤3.079 log10 SCO versus ALT≤60 IU/L in tandem with HBeAg>3.079 log10 SCO, 5.638 5 (3.496 8 to 9.091 9);ALT>60 IU/L in parallel with HBV DNA≤7.477 log10 IU/mL versus ALT≤60 IU/L in tandem with HBV DNA>7.477 log10 IU/mL, 8.975 4 (5.580 9 to 14.434 7). 图 3 较低水平基线ALT串联较高水平基线HBV复制标志物患者和较高水平基线ALT并联较低水平基线HBV复制标志物患者的Kaplan-Meier无ESC生存曲线 Fig. 3 Kaplan-Meier ESC-free survival curves for patients with baseline lower levels of ALT in tandem with higher levels of HBV replication markers and with baseline higher levels of ALT in parallel with lower levels of HBV replication markers |
| Time point (months) | ALT≤60 IU/L and HBsAg>4.602 log10 IU/mL | ALT>60 IU/L or HBsAg≤4.602 log10 IU/mL | Overlap of 95% CI | |||||
| ESC-free probability | SE | 95%CI | ESC-free probability | SE | 95%CI | |||
| 12 | 0.939 | 0.019 6 | 0.900 6~0.977 4 | |||||
| 24 | 0.755 | 0.036 1 | 0.684 2~0.825 8 | |||||
| 36 | 0.966 | 0.033 9 | 0.899 6~1.000 0 | 0.682 | 0.040 0 | 0.603 6~0.760 4 | No | |
| 48 | 0.966 | 0.033 9 | 0.899 6~1.000 0 | 0.558 | 0.046 2 | 0.467 4~0.648 6 | No | |
| 60 | 0.966 | 0.033 9 | 0.899 6~1.000 0 | 0.438 | 0.051 0 | 0.338 0~0.538 0 | No | |
| 72 | 0.925 | 0.051 0 | 0.825 0~1.000 0 | 0.404 | 0.052 4 | 0.301 3~0.506 7 | No | |
| Time point (months) | ALT≤60 IU/L and HBsAg>3.079 log10 IU/mL | ALT>60 IU/L or HBsAg≤3.079 log10 IU/mL | Overlap of 95% CI | |||||
| ESC-free probability | SE | 95%CI | ESC-free probability | SE | 95%CI | |||
| 12 | 0.936 | 0.020 6 | 0.895 6~0.976 4 | |||||
| 24 | 0.973 | 0.026 7 | 0.920 7~1.000 0 | 0.750 | 0.037 3 | 0.676 9~0.823 1 | No | |
| 36 | 0.945 | 0.037 7 | 0.871 1~1.000 0 | 0.674 | 0.041 2 | 0.593 2~0.754 8 | No | |
| 48 | 0.916 | 0.046 7 | 0.824 5~1.000 0 | 0.555 | 0.047 1 | 0.462 7~0.647 3 | No | |
| 60 | 0.916 | 0.046 7 | 0.824 5~1.000 0 | 0.431 | 0.051 9 | 0.329 3~0.532 7 | No | |
| 72 | 0.877 | 0.058 3 | 0.762 7~0.991 3 | 0.398 | 0.053 1 | 0.293 9~0.502 1 | No | |
| Time point (months) | ALT≤60 IU/L and HBsAg>7.477 log10 IU/mL | ALT>60 IU/L or HBsAg≤7.477 log10 IU/mL | Overlap of 95% CI | |||||
| ESC-free probability | SE | 95%CI | ESC-free probability | SE | 95%CI | |||
| 12 | 0.936 | 0.020 6 | 0.895 6~0.976 4 | |||||
| 24 | 0.742 | 0.037 7 | 0.668 1~0.815 9 | |||||
| 36 | 0.972 | 0.027 4 | 0.918 3~1.000 0 | 0.667 | 0.041 4 | 0.585 9~0.748 1 | No | |
| 48 | 0.972 | 0.027 4 | 0.918 3~1.000 0 | 0.539 | 0.047 3 | 0.446 3~0.631 7 | No | |
| 60 | 0.972 | 0.027 4 | 0.918 3~1.000 0 | 0.415 | 0.051 6 | 0.313 9~0.516 1 | No | |
| 72 | 0.932 | 0.047 6 | 0.838 7~1.000 0 | 0.382 | 0.052 5 | 0.279 1~0.484 9 | No | |
| ALT: alanine aminotransferase; HBsAg: hepatitis B surface antigen; HBeAg: hepatitis B e antigen; HBV DNA: hepatitis B virus DNA; ESC: HBeAg seroconversion; log10: logarithmic number with base 10. | ||||||||
以预测ESC的功能截断值作为分组依据,较低水平基线ALT串联较高水平基线HBV复制标志物患者和较高水平基线ALT并联较低水平基线HBV复制标志物患者的基线肝脏病理状态的构成比及其差异比较如表 3所示。较低水平基线ALT串联较高水平基线HBV复制标志物预测较低水平基线肝脏病理状态的诊断参数如表 4所示。
| Pathological condition | Proportion (%) | χ2 | P | |||
| ALT≤60 IU/L and HBsAg>4.602 log10 IU/mL | ALT>60 IU/L or HBsAg≤4.602 log10 IU/mL | |||||
| Grade≤G1 | 100.0(22/22) | 62.7(89/142) | 12.058a | 0.000 5 | ||
| Stage≤S1 | 68.2(15/22) | 48.6(69/142) | 2.908a | 0.088 1 | ||
| Grade≤G1 and stage≤S1 | 68.2(15/22) | 45.1(64/142) | 4.050a | 0.044 2 | ||
| Grade≤G2 and stage≤S1 | 68.2(15/22) | 48.6(69/142) | 2.908a | 0.088 1 | ||
| Grade≤G1 and stage≤S2 | 100.0(22/22) | 62.0(88/142) | 12.397a | 0.000 4 | ||
| Grade ≥G3 | 0.0(0/22) | 4.2(6/142) | 1.000 0b | |||
| Stage ≥S3 | 0.0(0/22) | 12.7(18/142) | 0.134 9b | |||
| Stage ≥S4 | 0.0(0/22) | 7.0(10/142) | 0.361 0b | |||
| Pathological condition | ALT≤60 IU/L and HBeAg>log10 3.079 SCO | ALT>60 IU/L or HBeAg≤3.079log10 SCO | χ2 | P | ||
| Grade≤G1 | 93.1(27/29) | 62.2(84/135) | 10.345a | 0.001 3 | ||
| Stage≤S1 | 65.5(19/29) | 48.1(65/135) | 2.865a | 0.090 5 | ||
| Grade≤G1 and stage≤S1 | 62.1(18/29) | 45.2(61/135) | 2.709a | 0.099 8 | ||
| Grade≤G2 and stage≤S1 | 65.5(19/29) | 48.1(65/135) | 2.865a | 0.090 5 | ||
| Grade≤G1 and stage≤S2 | 93.1(27/29) | 61.5(83/135) | 10.743a | 0.001 0 | ||
| Grade ≥G3 | 0.0(0/29) | 4.4(6/135) | 0.591 9b | |||
| Stage ≥S3 | 0.0(0/29) | 13.3(18/135) | 0.044 9b | |||
| Stage ≥S4 | 0.0(0/29) | 7.4(10/135) | 0.211 6b | |||
| Pathological condition | ALT≤60 IU/L and HBV DNA>7.477 log10 IU/mL | ALT>60 IU/L or HBV DNA≤ 7.477 log10 IU/mL | χ2 | P | ||
| Grade≤G1 | 86.2(25/29) | 63.7(86/135) | 5.493a | 0.019 1 | ||
| Stage≤S1 | 69.0(20/29) | 47.4(64/135) | 4.413a | 0.035 7 | ||
| Grade≤G1 and stage≤S1 | 62.1(18/29) | 45.2(61/135) | 2.709a | 0.099 8 | ||
| Grade≤G2 and stage≤S1 | 69.0(20/29) | 47.4(64/135) | 4.413a | 0.035 7 | ||
| Grade≤G1 and stage≤S2 | 86.2(25/29) | 63.0(85/135) | 5.804a | 0.016 0 | ||
| Grade ≥G3 | 0.0(0/29) | 4.4(6/135) | 0.591 9b | |||
| Stage ≥S3 | 0.0(0/29) | 13.3(18/135) | 0.044 9b | |||
| Stage ≥S4 | 0.0(0/29) | 7.4(10/135) | 0.211 6b | |||
| ALT: alanine aminotransferase; HBsAg: hepatitis B surface antigen; HBeAg: hepatitis B e antigen; HBV DNA: hepatitis B virus DNA; ESC: HBeAg seroconversion; log10: logarithmic number with base 10. aPearson chi-square test; bFisher exact test. | ||||||
| ALT≤60 IU/L and HBsAg>4.602 log10 IU/mL | Sensitivity (%) | Specificity (%) | Positive likelihood ratio | Negative likelihood ratio | Accuracy |
| Grade≤G1 | 19.8(22/111) | 100.0(53/53) | +∞ | 0.802 | 0.457 |
| Stage≤S1 | 17.9(15/84) | 91.2(73/80) | 2.034 | 0.900 | 0.537 |
| Grade≤G1 and stage≤S1 | 19.0(15/79) | 91.8(78/85) | 2.317 | 0.882 | 0.567 |
| Grade≤G2 and stage≤S1 | 17.9(15/84) | 91.2(73/80) | 2.034 | 0.900 | 0.537 |
| Grade≤G1 and stage≤S2 | 20.0(22/110) | 100.0(54/54) | +∞ | 0.800 | 0.463 |
| ALT≤60 IU/L and HBeAg>3.079 log10 SCO | Sensitivity (%) | Specificity (%) | Positive likelihood ratio | Negative likelihood ratio | Accuracy |
| Grade≤G1 | 24.3(27/111) | 96.2(51/53) | 6.395 | 0.787 | 0.476 |
| Stage≤S1 | 22.6(19/84) | 87.5(70/80) | 1.808 | 0.885 | 0.543 |
| Grade≤G1 and stage≤S1 | 22.8(18/79) | 87.1(74/85) | 1.767 | 0.886 | 0.561 |
| Grade≤G2 and stage≤S1 | 22.6(19/84) | 87.5(70/80) | 1.808 | 0.885 | 0.543 |
| Grade≤G1 and stage≤S2 | 24.5(27/110) | 96.3(52/54) | 6.622 | 0.784 | 0.482 |
| ALT≤60 IU/L and HBV DNA>7.477 log10 IU/mL | Sensitivity (%) | Specificity (%) | Positive likelihood ratio | Negative likelihood ratio | Accuracy |
| Grade≤G1 | 22.5(25/111) | 92.5(49/53) | 3.000 | 0.838 | 0.451 |
| Stage≤S1 | 23.8(20/84) | 88.7(71/80) | 2.106 | 0.859 | 0.555 |
| Grade≤G1 and stage≤S1 | 22.8(18/79) | 87.1(74/85) | 1.767 | 0.886 | 0.561 |
| Grade≤G2 and stage≤S1 | 23.8(20/84) | 88.7(71/80) | 2.106 | 0.859 | 0.555 |
| Grade≤G1 and stage≤S2 | 22.7(25/110) | 92.6(50/54) | 3.068 | 0.835 | 0.457 |
| ALT: alanine aminotransferase; HBsAg: hepatitis B surface antigen; HBeAg: hepatitis B e antigen; HBV DNA: hepatitis B virus DNA; ESC: HBeAg seroconversion; log10: logarithmic number with base 10. | |||||
ESC和无ESC亚队列患者在随访起点和随访期间发生过显著、严重及凶危型坏死性炎症的频率分别为67.5%(52/77)和53.9%(55/102)、20.8%(16/77)和11.8%(12/102)及1.3%(1/77)和0.0%(0/102),发生过显著、广泛及结节性纤维化的频率分别为79.2%(61/77)和66.7%(68/102)、36.4%(28/77)和37.3%(38/102)及27.3%(21/77)和21.6%(22/102)。
以预测ESC的功能截断值作为分组依据,较低水平基线ALT串联较高水平基线HBsAg和较高水平基线ALT并联较低水平基线HBsAg患者在随访起点和随访期间发生过显著、严重及凶危型坏死性炎症的频率分别为20.0%(6/30)和67.8%(101/149)、6.7%(2/30)和17.4%(26/149)及0.0%(0/30)和0.7%(1/149),发生过显著、广泛及结节性纤维化的频率分别为63.3%(19/30)和73.8%(110/149)、16.7%(5/30)和40.9%(61/149)及10.0%(3/30)和26.8%(40/149);较低水平基线ALT串联较高水平基线HBeAg和较高水平基线ALT并联较低水平基线HBeAg患者在随访起点和随访期间发生过显著、严重及凶危型坏死性炎症的频率分别为29.7%(11/37)和67.6%(96/142)、5.4%(2/37)和18.3%(26/142)及0.0%(0/37)和0.7%(1/142),发生过显著、广泛及结节性纤维化的频率分别为62.2%(23/37)和74.6%(106/142)、18.9%(7/37)和41.5%(59/142)及10.8%(4/37)和27.5%(39/142);较低水平基线ALT串联较高水平基线HBV DNA和较高水平基线ALT并联较低水平基线HBV DNA患者在随访起点和随访期间发生过显著、严重及凶危型坏死性炎症的频率分别为35.1%(13/37)和66.2%(94/142)、10.8%(4/37)和16.9%(24/142)及0.0%(0/37)和0.7%(1/142),发生过显著、广泛及结节性纤维化的频率分别为64.9%(24/37)和73.9%(105/142)、27.0%(10/37)和39.4%(56/142)及13.5%(5/37)和26.8%(38/142)。
3 讨论慢性HBV感染自然史的有序演变是一个不争的事实。但是,它的病毒学、免疫学机制尚未被阐明[19-23],它的病理学、生化学标准仍存在分歧[1-4, 7, 24]。仅基于病毒学、免疫学机制或病理学、生化学标准定义的自然史分期,不能充分体现自然史演变的内在含义和共同特征。因此,慢性HBV感染自然史分期的命名方案及其标准探索应回归到临床视角[7, 24]。将连续的自然史分期依次冠名为HBeAg阳性慢性感染和慢性肝炎及HBeAg阴性慢性感染和慢性肝炎,这混淆了感染与感染病的概念[24]。因此,本研究将连续的自然史分期依次称为HBeAg阳性NAH和AH及HBeAg阴性NAH和AH[5]。
HBeAg阳性NAH以肝脏“持续性”轻微病变为特征[1-5]。从HBeAg阳性NAH到HBeAg阳性AH,须经历一个肝脏组织学演变过程。虽然HBeAg阳性AH以肝脏侵袭性病变为特征,但也可表现为肝脏“持续性”或“间歇性”轻微病变[5, 7]。肝脏侵袭性病变的发生是HBeAg阳性NAH终结后的一个直接终点事件。理论上,识别HBeAg阳性NAH的无创实验室指标可靠标准(perfect standard)的建立和评价,应以随访队列为基础,并以肝脏侵袭性病变的首次发生为参照。但是,规律监测病理学变化有悖伦理,而且肝脏侵袭性病变不一定表现为显著坏死性炎症或显著纤维化。自发性ESC的发生是HBeAg阳性NAH终结后的一个间接终点事件。因此,本文基于一个随访队列,以自发性ESC为参照,采用Kaplan-Meier生存曲线分析,指定了ALT和HBV复制标志物预测未来发生ESC的功能截断值,并在此基础上,评价了ALT串联HBV复制标志物识别HBeAg阳性NAH的性能。
ROC曲线分析是确定鉴别HBeAg阳性NAH与HBeAg阳性AH的无创实验室指标的折中截断值的基本方法。就本文资料而言,ROC曲线分析可设定2个状态变量:终点事件自发性ESC和基线肝脏“显著坏死性炎症或显著纤维化”。虽然,以基线肝脏“显著坏死性炎症或显著纤维化”作为状态变量与以终点事件自发性ESC作为状态变量获得的ALT和HBV复制标志物的折中截断值非常接近(数据未显示),但是,以终点事件自发性ESC作为状态变量获得的ALT和HBV复制标志物的折中截断值应当更加准确。HBeAg阳性NAH以低水平ALT和高水平复制标志物为特征[1-4],因此,本文以ALT和HBV复制标志物预测ESC的折中截断值为基准,按照预测ESC的灵敏度的递升顺序,选择了多个便于应用的有序截断值,通过进行多次Kaplan-Meier生存分析,优选了预测未来发生ESC的功能截断值(落选的有序截断值未显示),亦即鉴别HBeAg阳性NAH与HBeAg阳性AH的功能截断值。根据本文数据,ALT≤60 IU/L及HBsAg>4.602 log10 IU/mL、HBeAg>3.079 log10 SCO和HBV DNA>7.477 log10 IU/mL为识别HBeAg阳性NAH的功能截断值。本文结果显示,ALT≤60 IU/L识别HBeAg阳性NAH的能力大于HBsAg>4.602 log10 IU/mL、HBeAg>3.079 log10 SCO和HBV DNA>7.477 log10 IU/mL,提示在HBeAg阳性NAH向HBeAg阳性AH的过渡期,HBV复制标志物的个体差异或时序变化大于ALT。
HBeAg阳性慢性HBV感染患者涵盖了HBeAg阳性NAH、HBeAg阳性NAH向HBeAg阳性AH过渡和HBeAg阳性AH 3个亚群,依次以高水平、高到中水平和低到中水平HBV复制为特征[7]。HBeAg阳性NAH向HBeAg阳性AH过渡亚群与HBeAg阳性AH亚群患者HBV复制水平的反向演变,决定了HBV复制标志物在识别HBeAg阳性NAH的特殊地位:HBV复制标志物是界定HBeAg阳性NAH与HBeAg阳性AH的必备参数。但是,本研究和本课题组前期研究[7]的结果均显示,单用HBV复制标志物识别HBeAg阳性NAH的作用有限。为此,本文进一步评价了基于功能截断值的HBV复制标志物串联ALT预测未来发生ESC的可能性。结果发现,随访2年后,ALT≤60 IU/L串联HBsAg>4.602 log10 IU/mL和串联HBV DNA>7.477 log10 IU/mL的患者发生ESC的概率均为0,而ALT>60 IU/L并联HBsAg≤4.602 log10 IU/mL和并联HBV DNA≤7.477 log10 IU/mL的患者发生ESC的概率分别为24.5%和25.8%;随访前6年各固定时间点,ALT≤60 IU/L串联HBsAg>4.602 log10 IU/mL和串联HBV DNA>7.477 log10 IU/mL的患者发生ESC的概率均显著低于ALT>60 IU/L并联HBsAg≤4.602 log10 IU/mL和并联HBV DNA≤7.477 log10 IU/mL的患者。
基于本文的基线数据,ALT≤60 IU/L串联HBsAg>4.602 log10 IU/mL的患者中,肝脏病理学分级≤G1和病理学分级≤G1且分期≤S2的构成比均为100%,而肝脏病理学分期≤S1和病理学分级≤G2且分期≤S1的构成比均为68.2%。ALT≤60 IU/L串联HBV DNA>7.477 log10 IU/mL的患者中,肝脏病理学分级≤G1和病理学分级≤G1且分期≤S2的构成比均为86.2%,而病理学分期≤S1和病理学分级≤G2且分期≤S1的构成比均为69.0%。以ALT≤60 IU/L串联HBsAg>4.602 log10 IU/mL为标准,其识别肝脏病理学分级≤G1和病理学分级≤G1且分期≤S2的灵敏度分别为19.8%和20.0%,特异度均为100%,阳性似然比均为+∞,阴性似然比分别为0.802和0.800;识别病理学分期≤S1和病理学分级≤G2且分期≤S1的灵敏度均为17.9%,特异度均为91.2%,阳性似然比均为+∞,阴性似然比分别为0.802和0.800。以ALT≤60 IU/L串联HBV DNA>7.477 log10 IU/mL为标准,其识别肝脏病理学分级≤G1和病理学分级≤G1且分期≤S2的灵敏度分别为22.5%和22.7%,特异度分别为92.5%和92.6%,阳性似然比分别为3.000和3.068,阴性似然比分别为0.838和0.835;识别病理学分期≤S1和病理学分级≤G2且分期≤S1的灵敏度均为23.8%,特异度均为88.7%,阳性似然比均为2.106,阴性似然比均为0.859。以上结果提示ALT≤60 IU/L串联HBsAg>4.602 log10 IU/mL和串联HBV DNA>7.477 log10 IU/mL均可有效地识别肝脏轻微坏死性炎症,但识别肝脏轻微纤维化的能力仍较为有限。本文的结果也验证了本课题组前期基于超大样本的断面研究[7]的结论:HBsAg>4.602 log10 IU/mL可能是识别HBeAg阳性NAH最有效的功能截断值; ALT≤60 IU/L串联HBsAg>4.602 log10 IU/mL识别轻微坏死性炎症的性能优于其串联HBV DNA>7.477 log10 IU/mL。
本课题组的前期研究[24]还发现,压低ALT的功能截断值,如ALT≤40 IU/L、≤30 IU/L或≤20 IU/L串联HBsAg>4.602 log10 IU/mL,并不会进一步提升HBsAg>4.602 log10 IU/mL识别HBeAg阳性NAH的性能。本研究的结果也提示,从HBeAg阳性NAH到HBeAg阳性AH,可能经历了一个相当长时间的过渡期。在过渡期,肝脏显著坏死性炎症和显著纤维化可能反复发生,但不会招致肝脏严重和凶危型坏死性炎症及广泛的结节性纤维化的发生; 与此同时,HBV复制标志物的水平可能围绕本文指定的功能截断值出现波动,而ALT水平可能在本研究指定的功能截断值之下发生震荡。
本研究非规律性肝脏病理学动态随访发现,ESC亚队列在随访期间发生过严重和凶危型坏死性炎症的频率分别为20.8%和1.3%,发生过广泛和结节性纤维化的频率分别为36.4%和27.3%;无ESC亚队列在随访期间发生过严重和凶危型坏死性炎症的频率分别为11.8%和0.0%,发生过广泛和结节性纤维化的频率分别为37.3%和21.6%。提示在自发性ESC发生之前,约15%的患者可能发生严重坏死性炎症,约25%的患者可能发生结节性纤维化。
本研究也存在一些缺陷和不足。第一,研究对象均为成年患者,其结论不一定适合儿童患者。第二,受样本量的限制,没有对ALT的功能截断值的性别差异进行分析。第三,HBV DNA的检测涉及2种方法,对HBV DNA功能截断值的选择和评价可能存在误差。第四,没有同步检测和评价其他新型HBV复制标记物(如HBcrAg和HBV RNA)。第五,本文结论还需要更多的纵向研究、基于更大的样本,进一步验证和讨论。
4 结论总而言之,建立慢性HBV感染自然史分期的可靠标准具有极其重要的临床与研究意义。HBeAg阳性NAH与HBeAg阳性AH的准确界定是自然史分期研究中的一个难点。本文基于一个长期随访队列,探讨了临床可及的实验室参数ALT及HBV复制标记物HBsAg、HBeAg和HBV DNA及其串联组合识别HBeAg阳性NAH的性能。从HBeAg阳性NAH到HBeAg阳性AH,可能须经历一个相当漫长的非显性的肝脏组织学演变过程。ALT≤60 IU/L及HBsAg>4.602 log10 IU/mL、HBeAg>3.079 log10 SCO和HBV DNA>7.477 log10 IU/mL可能是识别HBeAg阳性NAH的功能截断值; 基于功能截断值,ALT串联HBsAg、串联HBeAg和串联HBV DNA均可有效识别HBeAg阳性NAH,其中,ALT串联HBsAg可能是识别HBeAg阳性NAH的最佳参数或最佳标准。
| [1] |
Sarin SK, Kumar M, Lau GK, Abbas Z, Chan HL, Chen CJ, Chen DS, Chen HL, Chen PJ, Chien RN, Dokmeci AK, Gane E, Hou JL, Jafri W, Jia J, Kim JH, Lai CL, Lee HC, Lim SG, Liu CJ, Locarnini S, Al Mahtab M, Mohamed R, Omata M, Park J, Piratvisuth T, Sharma BC, Sollano J, Wang FS, Wei L, Yuen MF, Zheng SS, Kao JH. Asian-Pacific clinical practice guidelines on the management of hepatitis B: a 2015 update[J]. Hepatol Int, 2016, 10(1): 1-98.
[DOI]
|
| [2] |
European Association for the Study of the Liver. EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection[J]. J Hepatol, 2017, 67(2): 370-398.
[DOI]
|
| [3] |
Terrault NA, Lok ASF, McMahon BJ, Chang KM, Hwang JP, Jonas MM, Brown RS Jr, Bzowej NH, Wong JB. Update on prevention, diagnosis, and treatment of chronic hepatitis B: AASLD 2018 hepatitis B guidance[J]. Hepatology, 2018, 67(4): 1560-1599.
[DOI]
|
| [4] |
中华医学会肝病学分会, 中华医学会感染病学分会. 慢性乙型肝炎防治指南(2022年版)[J]. 中华传染病杂志, 2023, 41(1): 3-28. |
| [5] |
Desmet VJ. Histological classification of chronic hepatitis[J]. Acta Gastroenterol Belg, 1997, 60(4): 259-267.
[PubMed]
|
| [6] |
Yip TCF, Wong VWS, Wong GLH. Alanine aminotransferase level: the road to normal in 2021[J]. Hepatol Commun, 2021, 5(11): 1807-1809.
[DOI]
|
| [7] |
Zhang Z, Lu W, Huang D, Zhou X, Ding R, Li X, Wang Y, Lin W, Zeng D, Feng Y. Capabilities of hepatitis B surface antigen are divergent from hepatitis B virus DNA in delimiting natural history phases of chronic hepatitis B virus infection[J]. Front Immunol, 2022, 13: 944097.
[DOI]
|
| [8] |
Jaroszewicz J, Calle Serrano B, Wursthorn K, Deterding K, Schlue J, Raupach R, Flisiak R, Bock CT, Manns MP, Wedemeyer H, Cornberg M. Hepatitis B surface antigen (HBsAg) levels in the natural history of hepatitis B virus (HBV)-infection: a European perspective[J]. J Hepatol, 2010, 52(4): 514-522.
[DOI]
|
| [9] |
Nguyen T, Thompson AJV, Bowden S, Croagh C, Bell S, Desmond PV, Levy M, Locarnini SA. Hepatitis B surface antigen levels during the natural history of chronic hepatitis B: a perspective on Asia[J]. J Hepatol, 2010, 52(4): 508-513.
[DOI]
|
| [10] |
Maasoumy B, Wiegand SB, Jaroszewicz J, Bremer B, Lehmann P, Deterding K, Taranta A, Manns MP, Wedemeyer H, Glebe D, Cornberg M. Hepatitis B core-related antigen (HBcrAg) levels in the natural history of hepatitis B virus infection in a large European cohort predominantly infected with genotypes A and D[J]. Clin Microbiol Infect, 2015, 21(6): 606.e1-10.
[DOI]
|
| [11] |
Seto WK, Wong DKH, Fung J, Huang FY, Liu KSH, Lai CL, Yuen MF. Linearized hepatitis B surface antigen and hepatitis B core-related antigen in the natural history of chronic hepatitis B[J]. Clin Microbiol Infect, 2014, 20(11): 1173-1180.
[DOI]
|
| [12] |
Liu Y, Jiang M, Xue J, Yan H, Liang X. Serum HBV RNA quantification: useful for monitoring natural history of chronic hepatitis B infection[J]. BMC Gastroenterol, 2019, 19(1): 53.
[DOI]
|
| [13] |
Wang J, Yu Y, Li G, Shen C, Li J, Chen S, Zhang X, Zhu M, Zheng J, Song Z, Wu J, Shao L, Meng Z, Wang X, Huang Y, Zhang J, Qiu C, Zhang W. Natural history of serum HBV-RNA in chronic HBV infection[J]. J Viral Hepat, 2018, 25(9): 1038-1047.
[DOI]
|
| [14] |
章申琰, 沈忠良, 张继明. 乙型肝炎核心相关抗原的分子基础与临床应用[J]. 微生物与感染, 2023, 18(1): 35-45. [DOI]
|
| [15] |
Hu Y, Feng Z, Liu J, Chen J, Zhang S, Zhou YH. Virological determinants of spontaneous postpartum e antigen seroconversion and surface antigen seroclearance in pregnant women infected with hepatitis B virus[J]. Arch Med Res, 2016, 47(3): 207-213.
[DOI]
|
| [16] |
Song G, Rao H, Feng B, Wei L. Prediction of spontaneous HBeAg seroconversion in HBeAg-positive chronic hepatitis B patients during the immune clearance phase[J]. J Med Virol, 2014, 86(11): 1838-1844.
[DOI]
|
| [17] |
Zhang ZQ, Shi BS, Lu W, Huang D, Wang YB, Feng YL. Quantitative serum HBV markers in predicting phases of natural history of chronic HBV infection[J]. J Virol Methods, 2021, 296: 114226.
[DOI]
|
| [18] |
Goodman ZD. Grading and staging systems for inflammation and fibrosis in chronic liver diseases[J]. J Hepatol, 2007, 47(4): 598-607.
[DOI]
|
| [19] |
Mason WS, Gill US, Litwin S, Zhou Y, Peri S, Pop O, Hong MLW, Naik S, Quaglia A, Bertoletti A, Kennedy PTF. HBV DNA integration and clonal hepatocyte expansion in chronic hepatitis B patients considered immune tolerant[J]. Gastroenterology, 2016, 151(5): 986-998.
[DOI]
|
| [20] |
Protzer U, Knolle P. "To be or not to be": immune tolerance in chronic hepatitis B[J]. Gastroenterology, 2016, 151(5): 805-806.
[DOI]
|
| [21] |
Kuipery A, Gehring AJ, Isogawa M. Mechanisms of HBV immune evasion[J]. Antiviral Res, 2020, 179: 104816.
[DOI]
|
| [22] |
Zhao HJ, Hu YF, Han QJ, Zhang J. Innate and adaptive immune escape mechanisms of hepatitis B virus[J]. World J Gastroenterol, 2022, 28(9): 881-896.
[DOI]
|
| [23] |
Lee HW, Chan HL. Unresolved issues of immune tolerance in chronic hepatitis B[J]. J Gastroenterol, 2020, 55(4): 383-389.
[DOI]
|
| [24] |
Zhang Z, Lu W, Zeng D, Huang D, Lin W, Yan L, Feng Y. Quantitative HBsAg versus HBV DNA in predicting significant hepatitis activity of HBeAg-positive chronic HBV infection[J]. J Clin Med, 2021, 10(23): 5617.
[DOI]
|
 2024, Vol. 19
2024, Vol. 19


