2. 北京中医药大学厦门医院肝病中心,福建 厦门 361000
2. Xiamen Hospital of Traditional Chinese Medicine, Beijing University of Traditional Chinese Medicine, Xiamen 361000, Fujian Province, China
慢性乙型肝炎仍是世界范围内重要的公共健康问题,由乙型肝炎病毒(hepatitis B virus,HBV)感染引起的持续存在的肝脏炎症能够导致肝纤维化、肝硬化、肝细胞癌等严重并发症[1]。据统计,我国乙型肝炎表面抗原(hepatitis B surface antigen,HBsAg)在普通人群中的携带率高达5%~6%,而与HBV相关的肝硬化和肝细胞癌患者分别约占其总数的77%和84%[2-3]。抗病毒治疗能有效降低慢性乙型肝炎(chronic hepatitis B,CHB)的进展风险,显著改善患者预后[4]。替诺福韦、丙酚替诺福韦及恩替卡韦等核苷(酸)类似物是目前的一线抗病毒药物,不仅能抑制病毒复制,而且能够抑制肝癌细胞的增殖与迁移[5-6],此外,部分研究认为,核苷(酸)类似物(nucleotide analogues,NAs)可能对免疫应答具有一定的调节作用[7]。但由于CHB患者的个体差异,以及机体免疫水平和生物学功能的不同,NAs的治疗效果和远期预后存在较大差异,并存在疗程长、易耐药、停药后复发率高等后续问题,因此寻求精准有效的疗效预测及监测指标、探索更有效的抗病毒通路仍是目前的研究热点。
白细胞介素-21是一种Ⅰ型细胞因子, 具有4个α-螺旋结构,是γ链(γ-chain,γ c)复合受体型细胞因子家族成员。它主要由活化的CD4+T亚群细胞[包括滤泡辅助性T细胞(Tfh)、辅助性T细胞17(Th17)]和自然杀伤(nature killer, NK)细胞等分泌。人白细胞介素-21(interleukin-21,IL-21)基因定位于4q26-27,编码由162个氨基酸组成的IL-21多肽前体,成熟的IL-21蛋白由133个氨基酸构成(相对分子质量约为15 000 Da),其中包括一段引导肽和122个氨基酸的成熟多肽[8]。IL-21作用靶点广泛,参与多种免疫反应,而血清IL-21水平能够反映机体免疫应答情况[9-10]。近年来,研究发现IL-21在CHB抗病毒治疗过程中扮演着重要角色,本文通过系统检索IL-21与NAs治疗病毒学应答、HBeAg血清学转换以及病毒复发相关临床研究,并进行Meta分析,以期为后续研究提供参考,为临床应用提供指导。
1 材料与方法 1.1 检索策略检索平台包括PubMed、Cochrane Library、EMbase、Web of Science、Springer Link、中国知网、CBM、万方数据库、维普系列数据库、独秀数据库。检索时间为2010年01月—2024年11月。英文检索以“CHB”或“chronic hepatitis B”或“chronic hepatitis”或“hepatitis B”和“IL-21”或“interleukin-21”和“NAs”或“tenofovir”或“cave”或“valium”或“lamivudine”或“adefovir”或“dipivoxil”或“nucleotide analogues”为检索词。中文检索关键词以“慢乙肝”或“慢性乙型肝炎”或“慢性乙型病毒性肝炎”和“白细胞介素-21”或“白介素-21”和“核苷(酸)类似物”或“替诺福韦”或“恩替卡韦”或“替比夫定”或“拉米夫定”或“阿德福韦酯”进行检索。
1.2 研究对象 1.2.1 纳入标准同时满足以下条件:①研究类型为队列研究或病例对照研究;②入组病例均来源于各医疗机构确诊的CHB患者,且具有明确的抗病毒指征;③治疗方案包括口服NAs;④观察及治疗时长均≥12周;⑤为2010年01月—2024年11月于国内外公开发表;⑥中文或英文文献;⑦研究结果中提供可进行统计分析的数据;⑧入组患者基线资料基本均衡。
1.2.2 排除标准满足以下任一条件:①经渥太华量表(The Newcastle Ottawa Scale,NOS)量表评分小于等于6星;②含儿童、青少年以及妊娠期、哺乳期患者;③治疗方案未采用NAs治疗;④24周内接受过干扰素治疗者;⑤合并其他肝病及免疫系统疾病者;⑥体外实验、动物实验。
1.3 质量评价由两位研究者采用交叉核对的方式,统一使用NOS量表对符合纳入标准的文献进行质量评价,大于6星即为高质量文献,如遇分歧通过讨论达成共识来解决。
1.4 数据提取由2位研究者对检索到的文献进行独立筛选,如对某研究纳排存在差异,则通过讨论达成共识来解决。对纳入的研究进行如下数据提取:①文献的一般信息;②样本量;③HBV DNA及HBeAg变化情况、HBV DNA复发情况;④IL-21水平。
1.5 统计学分析采用Review Manager 5.4软件进行Meta分析。采用I2和P值来评价纳入研究间的异质性大小。当P>0.1且I2<50%时,表明各项研究不存在统计学异质性,使用固定效应模型;反之,考虑本研究异质性偏大,采用随机效应模型。进行敏感性分析,剔除异质因素后采用固定效应模型或随机效应模型分析。纳入研究数量>10时通过漏斗图评估发表偏倚。
2 结果 2.1 文献检索与筛选结果共检索到文献1 083篇,剔除重复文献及综述、案例报道、评论、信件等510篇,阅读标题、摘要后,剔除内容明显不符者479篇。阅读全文,参照纳排标准,剔除文献80篇,剔除无法获得全文的文献2篇,最终纳入12项研究。文献筛选流程结果如图 1所示。
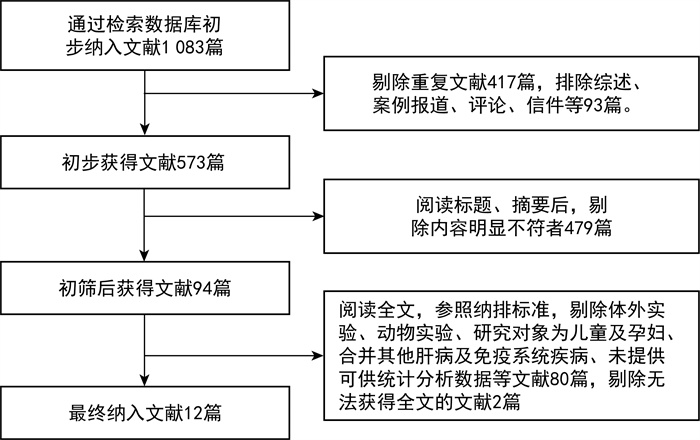
|
| 图 1 文献筛选流程以及结果 Fig. 1 Results and process of literature screening |
纳入的12项研究[11-22]中,有3篇研究了血清IL-21水平与NAs治疗后HBV DNA应答相关性,7篇研究了治疗期间IL-21水平与HBeAg血清学转阴的相关性,3篇研究了停药后IL-21水平与病毒复发之间的相关性。
2.3 纳入研究的特征及文献质量评价本次Meta分析共纳入12篇,且均为高质量文献。
2.4 数据分析的结果 2.4.1 血清IL-21水平与NAs治疗后HBV DNA应答相关性共纳入3项研究[11-13],经过异质性检验I2=97%,P<0.01,提示本组研究之间异质性偏大,进行敏感性分析,剔除王健等[12]这篇文献后异质性明显降低(I2=0%,P=0.51),采用固定效应模型分析后结果显示,HBV DNA完全应答组IL-21显著高于HBVDNA不全应答组(RR=24.94,95%CI为[20.09,29.80],Z=10.07,P<0.01)。具体结果如图 2所示。
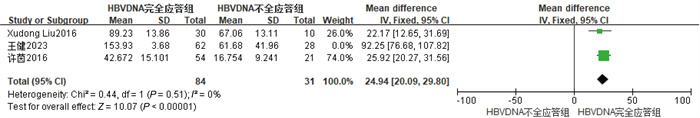
|
| 图 2 HBV病毒学应答的森林图 Fig. 2 Forest plot of HBV virological response |
共纳入7项研究[14-19],经过异质性检验(I2=85%,P<0.01),提示本组研究之间异质性偏大,进行敏感性分析,剔除邹敏等[19]、范清琪等[17]2篇文献后异质性明显降低(I2=42%,P=0.11),采用固定效应模型分析后结果显示,HBeAg转阴组IL-21显著高于HBeAg未转阴组(RR=34.22,95%CI为[29.01, 39.44],Z=12.86,P<0.01)。结果如图 3所示。
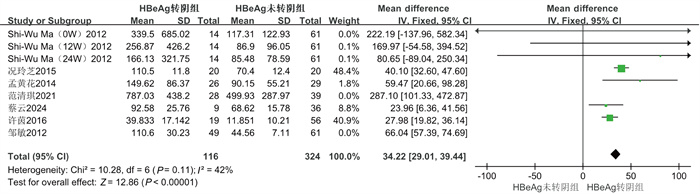
|
| 图 3 HBeAg血清学转阴的森林图 Fig. 3 Forest plot of HBeAg seroconversion |
共纳入3项研究[20-22],经过异质性检验(I2=75%,P<0.01),提示本组研究之间异质性偏大,采用随机效应模型分析后结果显示,病毒学持续应答组的IL-21水平显著高于病毒学复发组(RR=-11.67,95%CI为[-14.06, -9.28],Z=9.58,P<0.01),进行敏感性分析,剔除余希等[20]这篇文献后异质性明显降低(I2=0%,=0.55),采用固定效应模型分析后结果显示,结果同前(RR=-13.07,95%CI为[-15.51, -10.62],Z=10.47,P<0.01)。具体结果如图 4所示。
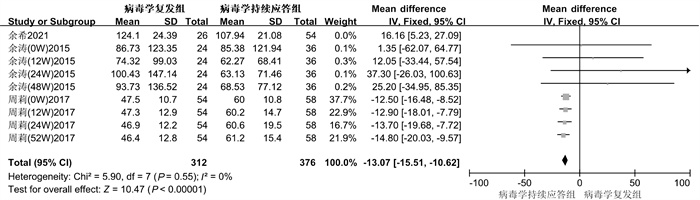
|
| 图 4 病毒学复发的森林图 Fig. 4 Forest plot of virological recurrence |
部分研究表明,血清IL-21水平与HBV DNA水平呈负相关[23-25],这与本文Meta分析的结果相符,IL-21水平的升高可能与NAs对免疫系统的间接影响有关。当机体持续暴露于高浓度病毒,抗原对T细胞反复触发会导致T细胞效应功能逐渐丧失,即出现T细胞衰竭。NAs治疗能有效抑制病毒复制,解除抗原高浓度状态对免疫系统活性的抑制,从而打破机体免疫耐受,促使T细胞更加活跃[22]。此外,现有研究已表明IL-21具有抗病毒作用。IL-21能够协助CD8+T细胞的增殖与分化,促进INF γ、颗粒酶B和CD107a等效应因子的释放。此外,IL-21还能维持T细胞的应答活性,并增强其细胞杀伤作用,从而加速病毒的清除[26]。且IL-21不仅能够在HBV感染初期联合IL-7、IL-15等调节NK细胞,介导天然免疫来清除病毒[9],还能在HBV慢性感染的过程中,通过激活STAT1等信号通路,上调NK细胞激活受体CD16、CD69和NKG2D等的表达,增加脱颗粒和细胞因子的释放,从而焕活NK细胞并显著提高其细胞毒性,进而改善HBV对NK细胞功能的损害[27-28]。基于其抗病毒属性,IL-21有望作为一种新型免疫调节药物运用于临床,并显示出了与NAs联合使用的潜力。Shen等[29]及其团队通过构建重组共价闭合环状DNA(covalently closed circular DNA,cccDNA)型HBV持续感染小鼠模型,并将表达IL-21的腺相关病毒(AAV-IL-21)注射于小鼠体内,其发现IL-21能够安全有效地诱导小鼠肝脏中重组cccDNA的清除,并诱导保护性记忆性T细胞的产生。此外,该团队的另两项研究也证实了IL-21治疗剂对病毒清除的有效性,并在提高IL-21治疗剂对肝组织的定向性以及疗效稳定性方面取得了一定的进展[30-31]。
本研究还进一步证实了IL-21水平与HBeAg血清学阴转有关。HBeAg转阴患者的IL-21水平显著升高,这同样可能与抗病毒治疗对机体免疫状态的影响有关。并且由Tfh分泌的大量IL-21能够作用于生发中心中的B细胞,直接活化B细胞并促使其分化,从而促使抗-HBe等HBV特异性抗体的产生以及病毒的清除[9, 32-33];而IL-21与其受体结合后,可通过激活JAK-STAT、NF-κB和MAPK等多条信号通路,参与调节下游基因的表达,进而影响免疫细胞功能[27]。胡璇等[34]的研究进一步表明,转阴组患者经NAs治疗后,相较于未发生HBeAg血清学阴转的CHB患者,其所携带的IL-21 rs12505138、rs17005929、rs6840978以及IL-21R rs8057551、rs8061992、rs3093301等多个基因位点的等位基因频率显著更高,这一结果为上述结论提供了基因学依据。此外,Ma等[14]的研究表明,NAs治疗12周时的IL-21水平可以独立预测治疗52周后的HBeAg血清学转换。这提示IL-21水平变化可以作为评估NAs远期治疗效果的一个重要指标,有助于临床及时调整治疗方案。
病毒学复发组的IL-21水平显著低于未复发组,这提示血清IL-21通过某些途径维持着停药后的病毒持续应答。监测停药时及停药后的IL-21水平,可以帮助临床评估患者停药后的复发风险,为临床筛选适合停药人群及继续治疗人群提供了指标依据。邱源旺[35]的研究采用单因素和多因素Cox比例风险模型(Cox proportional hazards model, Cox PH model)进行分析,其结果表明停药时的血清IL-21水平是停药后病毒学复发的独立影响因素;ROC分析显示,停药时的IL-21水平可以有效预测52周后的病毒复发率,其水平越低,复发率越高。
4 小结与展望血清IL-21可以作为评估患者治疗效果、协助调整抗病毒治疗方案以及评估患者预后的有效生物学标志物,能够为临床个体化诊疗提供准确、有效的指导,帮助临床提高患者的治疗效果。同时,通过调节IL-21水平或相关信号通路,可干预免疫系统的异常反应,促进病毒清除、减轻肝脏损伤、降低NAs停药后的病毒复发风险以及预防肝硬化和肝细胞癌等不良事件的发生。但基于IL-21复杂的生物学作用,其在CHB发展始终的变化规律以及所介导的病理生理学效应仍需更深入的研究。然而,IL-21作为预测指标,其敏感性、准确性和稳定性仍须进一步大规模研究来验证,从而确保其在实际临床应用中的价值和可靠性。此外,IL-21作为一种新型免疫调节药物目前仍在研发中,其有效性、安全性等仍须深入研究、进一步优化,与NAs联合治疗的具体方案以及相关疗效与预后仍有待研究。
| [1] |
中华医学会肝病学分会, 中华医学会感染病学分会. 慢性乙型肝炎防治指南(2022年版)[J]. 中华肝脏病杂志, 2022, 30(12): 1309-1331. [DOI]
|
| [2] |
赫捷, 陈万青, 沈洪兵, 李霓, 曲春枫, 石菊芳, 孙凤, 姜晶, 曹广文, 庄贵华, 彭绩. 中国人群肝癌筛查指南(2022, 北京)[J]. 中国肿瘤, 2022, 31(8): 587-631. |
| [3] |
秦叔逵. 中国原发性肝癌临床登记调查(CLCS)的中期报告[R/OL]. (2020-09-30)[2022-10-24]. https://mp.weixin.qq.com/s?_biz=MzA4ODQxMjgzNw==&mid=2653991033&idx=5&sn=9e4dd84a7~f01003~f09935~ed0122943~d2&chksm=8bee~97b~3bc~991~ea54~dc39~b8aeb~99056~e97085~f0fc~10bbe~4ffea~68f~0a1958~c23bc1~cf2a79~ab00&scene=27.
|
| [4] |
Murata K, Mizokami M. Possible biological mechanisms of entecavir versus tenofovir disoproxil fumarate on reducing the risk of hepatocellular carcinoma[J]. J Gastroenterol Hepatol, 2023, 38(5): 683-691.
[DOI]
|
| [5] |
Nguyen MH, Wong G, Gane E, Kao JH, Dusheiko G. Hepatitis B virus: advances in prevention, diagnosis, and therapy[J]. Clin Microbiol Rev, 2020, 33(2): e00046-19.
[DOI]
|
| [6] |
Zhao J, Zhou L, Zhang Y, Cheng J, Zeng Y, Li X. TDF and TAF inhibit liver cancer cell migration, invasion via p7TP3[J]. Sci Rep, 2024, 14(1): 8161.
[DOI]
|
| [7] |
刘肄辉, 冯慧, 刘莉, 周红娟, 张永华. 恩替卡韦对慢性乙型肝炎外周血Th9细胞动态变化的影响研究[J]. 中国预防医学杂志, 2020, 21(2): 163-167. [DOI]
|
| [8] |
Isvoranu G, Chiritoiu-Butnaru M. Therapeutic potential of interleukin-21 in cancer[J]. Front Immunol, 2024, 15: 1369743.
[DOI]
|
| [9] |
李媛, 黄古叶. IL-21在HBV感染中的作用[J]. 临床肝胆病杂志, 2017, 33(12): 2421-2424. [DOI]
|
| [10] |
Cai Y, Ji H, Zhou X, Zhao K, Zhang X, Pan L, Shi R. Interleukin-21 modulates balance between regulatory T cells and T-helper 17 cells in chronic hepatitis B virus infection[J]. BMC Infect Dis, 2023, 23(1): 719.
[DOI]
|
| [11] |
Liu X, Shen Z, Zhang H, Liang J, Lin H. Interleukin-21 is associated with early antiviral response in patients with hepatitis B e antigen-positive chronic hepatitis B and nonalcoholic fatty liver disease[J]. J Interferon Cytokine Res, 2016, 36(6): 367-373.
[DOI]
|
| [12] |
王健, 吴东洋, 郑建兴, 张金凤, 王利民. 恩替卡韦治疗HBeAg阳性慢性乙型肝炎抗病毒效应评估[J]. 中华医院感染学杂志, 2023, 33(5): 652-656. [DOI]
|
| [13] |
许茵, 华忠, 俞萍, 戴亚萍, 蒯守刚. 阿德福韦酯治疗慢性乙肝后细胞免疫水平的临床研究[J]. 中国现代医学杂志, 2016, 26(21): 94-96. [DOI]
|
| [14] |
Ma SW, Huang X, Li YY, Tang LB, Sun XF, Jiang XT, Zhang YX, Sun J, Liu ZH, Abbott WG, Dong YH, Naoumov NV, Hou JL. High serum IL-21 levels after 12 weeks of antiviral therapy predict HBeAg seroconversion in chronic hepatitis B[J]. J Hepatol, 2012, 56(4): 775-781.
[DOI]
|
| [15] |
孟黄花. 慢性乙型肝炎病毒感染者血清中IL-21水平的检测及意义初探[D]. 南充: 川北医学院, 2014.
|
| [16] |
况玲芝. 探讨IL-21、IL-2预测ETV治疗后HBeAg血清转换[D]. 南昌: 南昌大学, 2015. [URI]
|
| [17] |
范清琪, 汪婷, 陈沛冬, 汪月娥. HBeAg阳性慢性乙型病毒性肝炎患者外周血中分泌IL-21的CD4+ T细胞频数的检测及临床意义[J]. 中国感染与化疗杂志, 2021, 21(6): 659-663. [DOI]
|
| [18] |
蔡云, 赵凯, 潘良, 周鑫. IL-21参与HBeAg阳性慢性乙型肝炎的免疫发病机制的研究[J]. 肝脏, 2024, 29(4): 436-439. [DOI]
|
| [19] |
邹敏, 李珉珉, 李晓娟, 周元平, 刘叔文. 不同治疗方案对慢性乙型肝炎患者血清白介素21水平的影响[J]. 南方医科大学学报, 2012, 32(09): 1284-1286. [DOI]
|
| [20] |
余希, 莫金英, 肖蒲军, 詹雨林, 瞿志军. 血清IL-21水平与长期核苷类药物治疗CHB患者停药后临床复发的相关性[J]. 热带医学杂志, 2021, 21(9): 1167-1171. [DOI]
|
| [21] |
余涛. IL-21在核苷(酸)类药物治疗慢性乙型肝炎患者停药后的表达与临床意义[D]. 南方医科大学, 2015. [URI]
|
| [22] |
周莉, 邱源旺, 甘建和. 白细胞介素-21与HBeAg阳性慢性乙型肝炎患者恩替卡韦停药后复发的相关性[J]. 中华传染病杂志, 2017, 35(12): 725-729. [DOI]
|
| [23] |
Xiao L, Tang K, Fu T, Yuan X, Seery S, Zhang W, Ji Z, He Z, Yang Y, Zhang W, Jia W, Liang C, Tang H, Wang F, Ye Y, Chen L, Shao Z. Cytokine profiles and virological markers highlight distinctive immune statuses, and effectivenesses and limitations of NAs across different courses of chronic HBV infection[J]. Cytokine, 2024, 173: 156442.
[DOI]
|
| [24] |
Khanam A, Tang L SY, Kottilil S. Programmed death 1 expressing CD8+ CXCR5+ follicular T cells constitute effector rather than exhaustive phenotype in patients with chronic hepatitis B[J]. Hepatology, 2022, 75(3): 690-708.
[DOI]
|
| [25] |
Amin OE, Colbeck EJ, Daffis S, Khan S, Ramakrishnan D, Pattabiraman D, Chu R, Micolochick Steuer H, Lehar S, Peiser L, Palazzo A, Frey C, Davies J, Javanbakht H, Rosenberg WMC, Fletcher SP, Maini MK, Pallett LJ. Therapeutic potential of TLR8 agonist GS‐9688 (selgantolimod) in chronic hepatitis B: remodeling of antiviral and regulatory mediators[J]. Hepatology, 2021, 74(1): 55-71.
[DOI]
|
| [26] |
Tang L, Chen C, Gao X, Zhang W, Yan X, Zhou Y, Guo L, Zheng X, Wang W, Yang F, Liu G, Sun J, Hou J, Li Y. Interleukin 21 reinvigorates the antiviral activity of hepatitis B virus (HBV)-specific CD8+ T cells in chronic HBV infection[J]. J Infect Dis, 2019, 219(5): 750-759.
[DOI]
|
| [27] |
Jin Y, Sun Z, Geng J, Yang L, Song Z, Song H, Wang J, Tang J. IL-21 reinvigorates exhausted natural killer cells in patients with HBV-associated hepatocellular carcinoma in STAT1-depedent pathway[J]. Int Immunopharmacol, 2019, 70: 1-8.
[DOI]
|
| [28] |
Tang L, Li Q, Chen L, Li X, Gu S, He W, Pan Q, Wang L, Sun J, Yi X, Li Y. IL-21 collaborates with anti-TIGIT to restore NK cell function in chronic HBV infection[J]. J Med Virol, 2023, 95(10): e29142.
[DOI]
|
| [29] |
Shen Z, Liu J, Wu J, Zhu Y, Li G, Wang J, Luo M, Deng Q, Zhang J, Xie Y. IL-21-based therapies induce clearance of hepatitis B virus persistence in mouse models[J]. Theranostics, 2019, 9(13): 3798-3811.
[DOI]
|
| [30] |
Shen Z, Zhang S, Jiang Q, Liu N, Li F, Gao Z, Pan S, Hao W, Deng Q, Liu J, Zhang J, Xie Y. Lipid nanoparticle-mediated delivery of IL-21-encoding mRNA induces viral clearance in mouse models of hepatitis B virus persistence[J]. J Med Virol, 2023, 95(9): e29062.
[DOI]
|
| [31] |
Shen Z, Wu J, Gao Z, Wang J, Zhu H, Mao R, Wang X, Zhang J, Xie Y, Liu J. Characterization of IL-21-expressing recombinant hepatitis B virus (HBV) as a therapeutic agent targeting persisting HBV infection[J]. Theranostics, 2020, 10(12): 5600-5612.
[DOI]
|
| [32] |
高子翔, 沈忠良, 刘晶, 谢幼华. 细胞因子在慢性乙型肝炎治疗中的研究进展[J]. 临床肝胆病杂志, 2022, 38(8): 1710-1715. [DOI]
|
| [33] |
Ji L, Wei J, Zhang X, Gao Y, Fang M, Yu Z, Cao L, Gao Y, Li M. Bushen Formula promotes the decrease of HBsAg levels in patients with CHB by regulating Tfh cells and B-cell subsets[J]. J Ethnopharmacol, 2024, 328: 118072.
[DOI]
|
| [34] |
胡璇, 叶俊钊, 廖献花, 邵琮翔, 李福曦, 钟碧慧. IL-21和IFN基因多态性与慢性乙型肝炎疗效血清学应答的关系[J]. 实用医学杂志, 2018, 34(18): 2985-2989. |
| [35] |
邱源旺. 白细胞介素-21与慢性乙型肝炎患者恩替卡韦停药后复发的相关性研究[D]. 苏州: 苏州大学, 2017.
|
 2024, Vol. 19
2024, Vol. 19


