2. 中国人民解放军联勤保障部队第九○三医院烧伤整形科,浙江 杭州 310000
2. Department of Endocrinology, NO 903 Hospital of PLA Joint Logistic Support Force, Hangzhou 310013, Zhejiang Province, China
银屑病是一种多种因素参与的慢性炎症性皮肤病。流行病学调查结果显示,银屑病的发病率在全球各地呈逐年上升的趋势[1]。近年来有研究显示,肠道菌群多样性及结构的改变可能参与了银屑病的发生及发展[2-3]。目前,研究多仅限于使用16S rRNA测序技术对肠道中的细菌组成进行检测,鲜见针对银屑病患者肠道真菌多样性及结构的研究。内转录间隔区(internal transcribed spacer,ITS)基因测序技术是对真菌的ITS序列进行DNA测序,并通过与已知真菌的ITS序列对比,得到样本中真菌种属信息的一种新型测序技术。本研究采用ITS基因测序技术,对斑块状银屑病患者及健康人群肠道真菌菌群的多样性及丰度进行分析,并对比两组人群之间菌群结构的差异,以探索银屑病发病与肠道真菌之间的关系。
1 材料和方法 1.1 筛选样本和分组收集2021年1月—2021年12月就诊于河北医科大学第四医院皮肤科并被明确诊断为斑块状银屑病患者的基本资料,并分析其新鲜粪便。根据年龄和性别匹配原则,选取同期于河北医科大学第四医院皮肤科进行健康体检的健康者作为对照组。
根据纳排标准,本研究共纳入20例斑块状银屑病患者(银屑病组,P组)和10例健康者(健康对照组,C组)。纳入标准:①同意参与本研究,可以正常交流,配合完成标本收集工作;②年龄在13~69岁间;③PASI≥3分;④河北省常住人群。排除标准: ①胃肠道疾病或胃肠道手术史;②恶性肿瘤病史;③体股癣等真菌性疾病感染史;④近3个月内应用过抗细菌及真菌类药物、类固醇类药物、益生菌等可能影响肠道菌群的制剂;⑤腹泻、便秘、痔疮等影响粪便形态及清洁度的因素;⑥特定饮食习惯者;⑦产褥期、哺乳期及妊娠期患者。本研究通过河北医科大学第四医院伦理委员会批准,所有研究对象均阅读并签署了知情同意书。
1.2 标本收集用一次性无菌粪便采集杯收集所有研究对象的新鲜粪便,留样后30 min内取至少2 g样本,分别分装到2 mL无菌冻存管中,每人留取2份样本,标注患者基本信息、粪便编号、留样日期,置于-80 ℃冰箱冻存备用。
1.3 粪便样本DNA提取和聚合酶链式反应扩增根据制造商说明书使用DNA提取试剂盒(DNeasyⓇ PowerSoilⓇ Pro Kit,美国Qiagen)提取粪便样本DNA,并采用1%琼脂糖凝胶电泳检测DNA的完整性,样本于-80 ℃冻存备用。
使用无菌水将DNA样本稀释,根据ITS1F-ITS2R测序区域,选取相应的特异性引物序列进行扩增:ITS1F:CTTGGTCATTTAGAGGAAGTAA;ITS2R:GCTGCGTTCTTCATCGATGC。采用TransGen AP221-02:TransStart Fastpfu DNA Polymerase,20 μL反应体系进行聚合酶链式反应(polymerase chain reaction,PCR)扩增;反应条件为95 ℃初始变性3 min,95 ℃变性30 s、53 ℃退火30 s、72 ℃延伸45 s共30个循环,最后72 ℃延伸10 min;扩增结束后使用2%琼脂糖凝胶电泳检测PCR产物,并使用AxyPrep DNA Gel Extraction Kit对PCR产物进行纯化;最后使用QuantusTM Fluorometer对PCR产物进行定量检测。
1.4 ITS测序利用Illumina公司(美国)的NovaSeq PE250平台进行测序。将DNA片段一端与引物碱基互补,另一端与附近随机引物互补;将PCR扩增后的DNA扩增子线性化为单链后,加入带有荧光标记的dNTP,每次循环只合成一个碱基;用激光扫描反应板表面,读取聚合的核苷酸种类;将“荧光基团”和“终止基团”进行化学切割,恢复3 ′端黏性后继续聚合下一个核苷酸;重复上述操作,直至所有碱基合成并检测完毕,统计最终收集到的荧光信号结果,获取模板DNA片段序列。
1.5 信息处理使用fastp软件对Illumina NovaSeq测序得到的原始双端序列数据进行质控,使用FLASH软件进行拼接得到最终的有效数据。
1.6 统计学处理一般资料采用t检验和卡方检验来评价数据差异的显著性,P<0.05代表差异具有统计学意义。采用QIIME软件对α多样性及β多样性指数进行分析,运用R软件作图。
2 结果 2.1 一般资料根据纳排标准,共有20例银屑病患者和10例健康对照者被纳入本次研究,但有3名患者和3名健康对照者因缺失PCR扩增结果而无法进行后续实验。最终银屑病患者组(P组)共纳入17例患者,其中男性7例,女性10例;健康对照组(C组)共纳入7例,其中男性4例,女性3例。对P组和C组的年龄和身体质量指数(body mass index,BMI)采用t检验,性别采用卡方分析,结果显示差异无统计学意义(均P>0.05)(见表 1)。
| P组(n=17) | C组(n=7) | P值 | ||
| 年龄(岁) | 33.37±7.53 | 33.12±8.61 | P>0.05 | |
| 性别 | 男 | 7 | 4 | P>0.05 |
| 女 | 10 | 3 | ||
| BMI(kg/m2) | 23.20±1.55 | 22.91±2.15 | P>0.05 | |
从样本中随机抽取一定数量的数据,统计其所代表的物种,并绘制稀释曲线(rarefaction curve),用来反映样本的测序数据量是否合理。当曲线趋于平坦时,则说明测序数据量合理。在遗传学研究中,便于进行分析,人为对菌种数目信息进行归类操作,并将序列按照彼此的相似性分归为多个小组,一个小组就是一个分类操作单元(operational taxonomic unit,OTU)。本文以OTU数量为稀释曲线纵坐标,以测序的碱基数为横坐标。通过稀释曲线可以发现除P8之外,其余各样本在10 000碱基时曲线趋于平缓,说明增加测序数据量不会增加更多的OTU,测序深度足够,后续分析合理(见图 1)。

|
| 每条曲线均代表一个样本。 Each curve represents a sample. 图 1 稀释曲线 Fig. 1 Rarefaction curves |
本文利用Venn图更直观地展现出P组和C组共有和独有的OTU数目。结果显示,24个样本共有570个OTU,P组特有323个OTU,C组特有80个OTU,两组相同的OTU共167个(见图 2A)。

|
| A: 韦恩图:健康对照组(红色),银屑病患者组(绿色);B~D:门、属、种水平物种相对丰度柱状图。 A: Venn graph: healthy controls (red), psoriatic patients (green); B-D: The relative species abundance at phylum, genus, species levels. 图 2 肠道菌群物种组成 Fig. 2 Species composition of the gut microflora |
同时收集每个样本中OTU的丰度信息,对其在门、纲、目、科、属、种各分类水平上进行分析,生成物种相对丰度柱形图,可直观地反映P组和C组间菌群结构和差异,纵坐标为相对丰度,横坐标为分组。在门水平上,两组主要的优势菌种一致,为子囊菌门(Ascomycota)和担子菌门(Basidiomycota)(见图 2B)。在属水平上,两组主要优势菌种均为篮状菌属(Talaromyces)、曲霉属(Aspergillus)、念珠菌属(Candida)、青霉属(Penicillium)、酵母属(Saccharomyces)等(见图 2C)。在种水平上,两组主要优势菌种均为杜氏篮状菌(Talaromyces_duclauxii)、unidentified、清酒假丝酵母(Candida-sake)、酿酒酵母(Saccharomyces_cerevisiae)、帚状曲霉(Aspergillus_penicillioides)、泡盛曲霉(Aspergillus awamori)等(见图 2D)。
2.4 样本内复杂度分析(Alpha多样性)对两组样本内Alpha多样性进行相关分析,用来评估样本内物种丰度和多样性,主要指标包括chao 1和PD_whole_tree。对以上指数进行T检验,发现P组的chao 1和PD_whole_tree指数(74.41±33.84、16.96±6.64)较C组(72.96±33.42、14.81±5.52)升高,P组的Shannon和Simpson指数(3.10±1.49、0.70±0.28)较C组(3.53±1.18、0.80±0.15)稍有降低(P>0.05)。说明两组间差异无统计学意义(见表 2)。
| 多样性指数 | P组(M±SD) | C组(M±SD) | P值 |
| Chao 1 | 74.41±33.84 | 72.96±33.42 | 0.93 |
| PD_whole_tree | 16.96±6.64 | 14.81±5.52 | 0.48 |
| Shannon | 3.10±1.49 | 3.53±1.18 | 0.50 |
| Simpson | 0.70±0.28 | 0.80±0.15 | 0.39 |
| 注:M为平均值(mean),SD为标准差(standard deviation)。 | |||
为了更好地显示两组样本之间的距离关系,将加权的unifrac样本距离矩阵用热图表现出来。X和Y轴均为样本名称,样本之间的距离用不同颜色梯度表示,两样本间相似性越低,即差异性越大,格子颜色越红;相似性越高,即差异性越小,格子颜色越蓝(见图 3)。

|
| 图 3 基于加权的样本距离矩阵热图 Fig. 3 Weighted unifrac distance matrix |
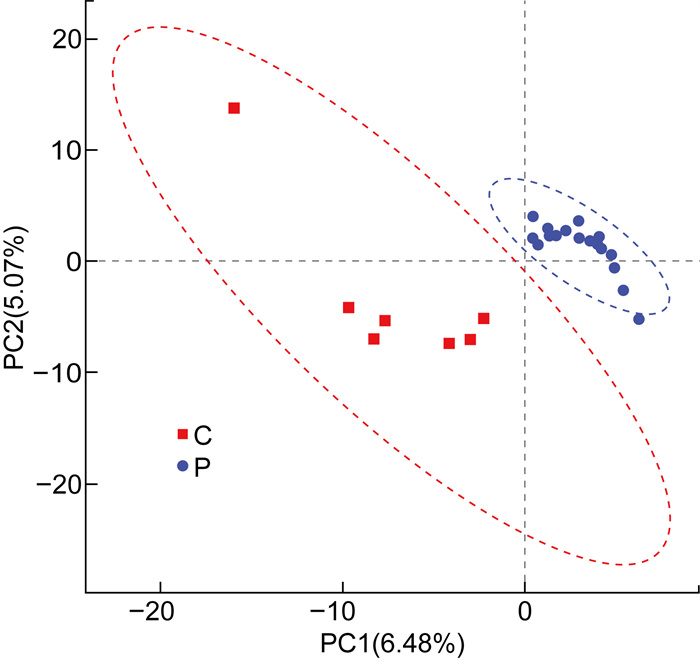
由于主成分分析(principal component analysis,PCA)对样本不进行区分,当两组样本的组间差异较小,组内差异明显时,PCA难以区分组间差异;如果组间的差异较小,两组的样本量相差较大,样本量大的一组会起主导作用,影响最终结果,因此本文进行PLS-DA分析以去除上述混杂因素。
横、纵坐标分别代表对两组样本菌群组成发生偏移的疑似影响因素,C组(红色)和P组(蓝色)的粪便样本各自聚集且完全分离,即2组菌群结构存在显著差异(见图 4)。
|
| 图 4 偏最小二乘法判别分析 Fig. 4 Partial least squares discriminant analysis |
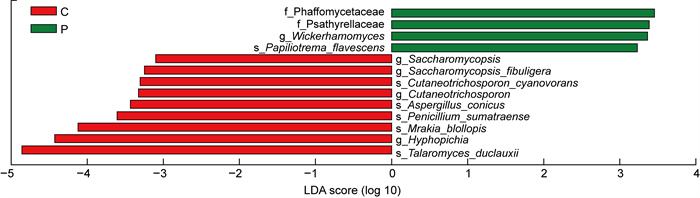
LEfSe分析用于发现2组样本中有显著差异的物种(即biomaker)以及这些特征对组间差异的影响程度。本文将LDA score阈值设定为3,柱状图的长度代表biomaker影响程度的大小。结果显示,LDA score>3的biomarker共13种,P组(绿色)丰度较高的biomarker为法夫酵母科(Phaffomycetaceae)、鬼伞科(Psathyrellaceae)、威克汉姆酵母菌属(Wickerhamomyces)、Papiliotrema_flavescens;C组(红色)丰度较高的biomarker为复膜孢酵母属(Saccharomycopsis)、扣囊复膜酵母种(Saccharomycopsis fibuligera)、Cutaneotrichosporon_cyanovorans、毛孢子菌属(Cutaneotrichosporon)、圆锥曲霉种(Aspergillus_conicus)、苏门答腊青霉种(Penicillium sumatraense)、木拉科酵母种(Mrakia blollopis)、丝孢毕赤氏酵母属(Hyphopichia)、杜氏篮状菌种(Talaromyces_duclauxii)(见图 5)。
|
| 图 5 LDA值分布柱状图 Fig. 5 LDA score histogram |
人类及动物胃肠道中存在细菌、真菌、病毒和古菌等多种微生物菌落[4]。肠道菌群与免疫系统的各种改变相关,可以加重自身免疫和炎症免疫介导的相关疾病[5-6]。有研究显示,肠道菌群和银屑病的发生及发展存在密切关系。前期本课题组对肠道细菌的研究结果显示,银屑病患者不仅肠道细菌结构发生了明显变化,而且还伴有肠道受损现象[7-8]。本文利用ITS基因测序技术,对斑块状银屑病患者及健康者的肠道真菌菌群多样性及结构进行了比较分析。
稀释曲线结果显示,除P8外,其余曲线均趋于平坦,说明本实验的后续分析结果具有一定的代表性及可信性。P8的曲线稍陡峭,不除外由该受试者取样前一天饮酒所造成。Alpha多样性分析结果显示,银屑病患者组肠道真菌的菌群丰度和多样性与健康对照组相比,均有小幅度升高,但无统计学差异。后续可引入更大样本量来进一步分析。Beta多样性的PLS-DA分析结果显示,两组菌群结构存在显著差异,提示肠道真菌的菌群结构及丰度可能与银屑病密切相关。考虑到个别差异会影响研究结果,后续本文进行了LEfSe分析,结果显示,法夫酵母科、鬼伞科、威克汉姆酵母菌属、Papiliotrema_flavescens 4种菌在银屑病患者组中的丰度显著升高;复膜孢酵母属、扣囊复膜酵母种、毛孢子菌属、圆锥曲霉种、苏门答腊青霉种、木拉科酵母种、丝孢毕赤氏酵母属、杜氏篮状菌种8种菌在银屑病患者组中丰度显著降低。以上发生改变的菌群大部分属于子囊菌门,且与健康对照组相比,无论是在科水平还是属水平上,子囊菌门分类水平下的酵母菌丰度均升高。
有研究显示,T细胞不仅可影响肠道微生物的稳定性,也可受肠道微生物的调节[9-10]。Waldman等[11]与Elsner等[12]的研究结果均显示,与健康对照组相比,银屑病患者肠道中念珠菌的检出率明显升高。他们推断,念珠菌属可能是银屑病的诱发因素,银屑病患者肠道内的念珠菌可以特异性地向皮肤分泌超抗原,从而诱导靶向Vβ-TCR的T淋巴细胞增殖,进而导致出现银屑病的皮损。另有研究显示,应用益生菌和粪便微生物移植对银屑病治疗有明显疗效[13-14]。因此本文推测,肠道微生物与T细胞和银屑病密切相关。
溃疡性结肠炎(ulcerative colitis,UC)患者肠道中子囊菌门为优势菌群[15],并且其分类水平下的威克汉姆酵母菌属数量与肿瘤坏死因子α (tumor necrosis factor-α, TNF-α)的表达呈正相关。酿酒酵母也可通过抑制巨噬细胞凋亡和调节肠道菌群成为UC的有效治疗策略[16]。另有研究发现,克罗恩病(Crohn’s disease,CD)患者肠道中的酵母菌细胞壁成分明显高于健康人群[17],其菌壁成分可以刺激单核细胞分泌TNF-α。因此本文推测,酵母菌可能通过促进炎症因子的分泌,从而增加肠道炎症反应。阿达木单抗为TNF-α抑制剂,银屑病患者中也存在TNF-α炎症因子的升高。一项银屑病合并炎症性肠病(inflammatory bowel disease,IBD)的临床实验结果表明,使用阿达木单抗[18]治疗16周后,患者的银屑病及IBD的临床症状均有明显改善。以上结论进一步提示,银屑病与IBD可能存在相近的肠道炎症反应和发病机制。
综上所述,肠道真菌菌群结构的变化与银屑病的发病相关。就其作用机制本文推测,银屑病患者肠道中显著升高的真菌一方面分泌致炎物质导致肠道炎症,另一方面通过破坏肠粘膜屏障使局部炎症向全身扩散,在皮肤上表现为银屑病的皮损。由于肠道菌群受饮食、生活习惯、种族、地理位置等多因素的影响,未来如能开展更大样本量及多中心的研究,所得结果将更具说服力。
| [1] |
AlQassimi S, AlBrashdi S, Galadari H, Hashim MJ. Global burden of psoriasis-comparison of regional and global epidemiology, 1990 to 2017[J]. Int J Dermatol, 2020, 59(5): 566-571.
[DOI]
|
| [2] |
Shapiro J, Cohen NA, Shalev V, Uzan A, Koren O, Maharshak N. Psoriatic patients have a distinct structural and functional fecal microbiota compared with controls[J]. Dermatol, 2019, 46(7): 595-603.
[DOI]
|
| [3] |
王丽玮, 段志敏, 童建波, 曾荣, 徐浩翔, 李岷. 银屑病患者肠道菌群多样性分析: 单中心前瞻性研究[J]. 协和医学杂志, 2019, 10(3): 223-230. [DOI]
|
| [4] |
Hollister EB, Gao C, Versalovic J. Compositional and functional features of the gastrointestinal microbiome and their effects on human health[J]. Gastroenterology, 2014, 146(6): 1449-1458.
[DOI]
|
| [5] |
Jiao Y, Wu L, Huntington ND, Zhang X. Crosstalk between gut microbiota and innate immunity and its implication in autoimmune diseases[J]. Front Immunol, 2020, 11: 282.
[DOI]
|
| [6] |
Piccioni A, Cicchinelli S, Valletta F, De Luca G, Longhitano Y, Candelli M, Ojetti V, Sardeo F, Navarra S, Covino M, Franceschi F. Gut microbiota and autoimmune diseases: a charming real world together with probiotics[J]. Curr Med Chem, 2022, 29(18): 3147-3159.
[DOI]
|
| [7] |
孟悦. 基于16SrRNA测序的银屑病患者肠道菌群结构的研究[D]. 河北: 河北医科大学, 2021.
|
| [8] |
张小垒. 银屑病患者与健康人肠道菌群的比较研究[D]. 河北: 河北医科大学, 2020.
|
| [9] |
Honda K, Littman DR. The microbiota in adaptive immune homeostasis and disease[J]. Nature, 2016, 535(7610): 75-84.
[DOI]
|
| [10] |
Schnell A, Huang L, Singer M, Singaraju A, Barilla RM, Regan BML, Bollhagen A, Thakore PI, Dionne D, Delorey TM, Pawlak M, Meyer Zu Horste G, Rozenblatt-Rosen O, Irizarry RA, Regev A, Kuchroo VK. Stem-like intestinal Th17 cells give rise to pathogenic effector T cells during autoimmunity[J]. CELL, 2021, 184(26): 6281-6298.
[DOI]
|
| [11] |
Waldman A, Gilhar A, Duek L, Berdicevsky I. Incidence of Candida in psoriasis—a study on the fungal flora of psoriatic patients[J]. Mycoses, 2001, 44(3/4): 77-81.
[DOI]
|
| [12] |
Elsner K, Holstein J, Hilke FJ, Blumenstock G, Walker B, Schmidt S, Schaller M, Ghoreschi K, Meier K. Prevalence of Candida species in Psoriasis[J]. Mycoses, 2021, 65(2): 247-254.
[DOI]
|
| [13] |
Polak K, Bergler-Czop B, Szczepanek M, Wojciechowska K, Frątczak A, Kiss N. Psoriasis and gut microbiome-Current state of art[J]. Int J Mol Sci, 2021, 22(9): 4529.
[DOI]
|
| [14] |
Buhaş MC, Gavrilaş LI, Candrea R. Gut Microbiota in Psoriasis[J]. Nutrients, 2022, 14(14): 2970.
[DOI]
|
| [15] |
Qiu X, Ma J, Jiao C, Mao X, Zhao X, Lu M, Wang K, Zhang H. Alterations in the mucosa-associated fungal microbiota in patients with ulcerative colitis[J]. Oncotarget, 2017, 8(64): 107577-107588.
[DOI]
|
| [16] |
Sun S, Xu X, Liang L, Wang X, Bai X, Zhu L, He Q, Liang H, Xin X, Wang L, Lou C, Cao X, Chen X, Li B, Wang B, Zhao J. Lactic acid-producing probiotic saccharomyces cerevisiae attenuates ulcerative colitis via suppressing macrophage pyroptosis and modulating gut microbiota[J]. Front Immunol, 2021, 12: 777665.
[DOI]
|
| [17] |
Torres J, Petralia F, Sato T, Wang P, Telesco SE, Choung RS, Strauss R, Li XJ, Laird RM, Gutierrez RL, Porter CK, Plevy S, Princen F, Murray JA, Riddle MS, Colombel JF. Serum biomarkers identify patients who will develop inflammatory bowel diseases up to 5 years before diagnosis[J]. Gastroenterology, 2020, 159(1): 96-104.
[DOI]
|
| [18] |
Piqueras M, Monfort D, Pol MA, Galter S, Modolell I, Ortiz J, Boadas J. Use of adalimumab in a patient with Crohn's disease and extensive generalised psoriasis who achieved complete remission of both conditions[J]. Gastroenterol Hepatol, 2013, 36(6): 396-399.
|
 2024, Vol. 19
2024, Vol. 19


