细菌的分泌系统参与细菌的物质运输,它通过将不同功能的效应蛋白转运出胞,在细菌的生存、致病性及菌群与宿主的相互作用等方面具有重要作用。迄今为止,已发现9种细菌分泌系统类型(T1SS~T9SS)。其中,T7SS是目前唯一的仅被发现存在于革兰氏阳性细菌中的分泌系统。它的发现源于对致病性结核分枝杆菌的研究。1995年,Andersen及其同事[1]从结核分枝杆菌的培养滤液中分离鉴定出了2种不含有传统Sec或是Tat途径的典型信号肽序列的效应蛋白:6-kDa早期分泌抗原靶标(early secreted antigenic target 6, ESAT-6)和与其共分泌的伴侣蛋白10-kDa培养滤液蛋白(10-kDa culture filtrate protein, CFP-10)(后分别更名为EsxA和EsxB)。针对这2种重要蛋白的分泌方式,他们猜想并通过消减杂交实验证明了结核分枝杆菌的遗传差异区1(region of difference-1, RD1)的基因编码的蛋白构成了一种全新的蛋白质分泌系统,介导了ESAT-6和CFP-10的分泌,后将该分泌系统命名为“Ⅶ型分泌系统(type Ⅶ secretion system, T7SS)”[2]。
T7SS作为一种仅存在于革兰氏阳性细菌中的分泌系统,其所分泌的效应蛋白在细菌与细菌、细菌与宿主细胞、细菌与环境等多维度、多层面的相互作用中发挥着重要功能。比如:T7SS可帮助细菌在种内竞争中取得优势,同时也可辅助细菌入侵宿主细胞,并在胞内生存、繁殖、扩散。但目前对于T7SS效应蛋白的界定尚不明确,并且对其功能的研究也并不全面。因此,本文将T7SS基因簇所编码的效应蛋白以及由T7SS基因簇之外的基因编码但通过T7SS分泌的蛋白都归为T7SS的效应蛋白,后围绕它们展开讨论。本文主要从效应蛋白角度分析T7SS功能的多样性,有望加深对T7SS的认识,并为发现全新的效应蛋白提供参考。
1 革兰氏阳性菌T7SS的分类自从高G+C含量的放线菌门细菌——结核分枝杆菌中发现T7SS后,研究人员又在低G+C含量的厚壁菌门细菌(如金黄色葡萄球菌、枯草芽孢杆菌等)中发现了与之同源的基因簇,但由于放线菌门和厚壁菌门细菌T7SS的序列相似性极低,遗传上不具有保守性,故将T7SS分为T7SSa(放线菌门)和T7SSb(厚壁菌门)两类[3](见图 1)。
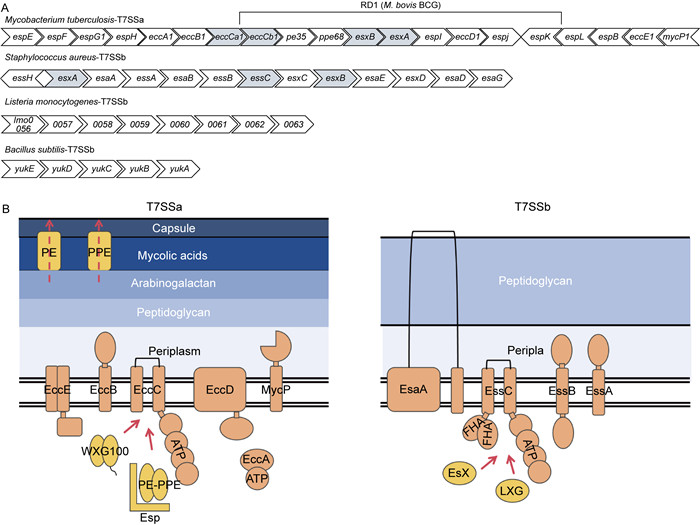
|
| In panel A, Mycobacterium tuberculosis(M. tuberculosis) contains the T7SSa gene cluster, where genes in the RD1 region encode various virulence proteins, and the deletion of RD1 is precisely the reason for the attenuation of the tuberculosis vaccine strain, Bacillus Calmette-Guérin (BCG). Staphylococcus aureus (S. aureus) contains the T7SSb gene cluster, but has extremely low sequence similarity to M. tuberculosis. Listeria monocytogenes and Bacillus subtilis also contain the T7SSb gene cluster, but the relevant researches are not in-depth. In panel B, the orange illustrations represent the membrane protein structures of the secretion system, such as EccE, EccB, EccC, EccD for T7SSa, and EssA, EssB, EssC for T7SSb. The yellow illustrations represent the effector proteins of the secretion system, such as the WXG100 proteins, PE-PPE proteins, Esp proteins secreted by T7SSa, and the Esx proteins, LXG proteins secreted by T7SSb. In T7SSa, effector proteins are secreted outside the cell through the pore formed by EccC. PE-PPE proteins have a transmembrane structure, are transported out of the inner membrane by EccC, stably embedded in the mycobacterial acid layer, and form a pore by aggregating through their own structural changes. The effector proteins of T7SSb are secreted out of the cell through the pore formed by EssC. EsaA is the only component of T7SSb that spans the entire cell envelope, presenting a 'needle tip-like' appearance. 图 1 含T7SSa和T7SSb的代表菌株基因簇构成(A)及分泌系统结构示意(B) Fig. 1 The composition of gene clusters containing T7SSa and T7SSb from representative strains (A) and the schematic diagrams of the two secretion system structures (B) |
其中,放线菌门的代表细菌结核分枝杆菌具有5种T7SSa亚型(ESX-1~ESX-5),它们分别由5个同源esx基因簇(esx-1~esx-5)编码[4]。esx基因簇在分枝杆菌属中分布广泛,但在不同种分枝杆菌中的数量存在差异,比如:病原菌致病性结核分枝杆菌基因组中含有5种esx基因簇,但麻风分枝杆菌和脓肿分枝杆菌仅分别含有4种和2种esx基因簇;而非致病菌耻垢分枝杆菌也仅含有4种esx基因簇。目前,在5种T7SSa亚型中,ESX-1亚型由于参与细菌重要效应蛋白EsxA和EsxB的分泌,故研究较多,而针对其余4种T7SSa亚型的研究较少。
厚壁菌门的金黄色葡萄球菌的基因组中存在与结核分枝杆菌同源的esx基因簇[5]。但不同于结核分枝杆菌所含有的5种T7SSa亚型,金黄色葡萄球菌的T7SSb仅由单一的esx基因簇所编码,且与结核分枝杆菌的基因簇在序列上不具有相似性。
不同的基因簇序列编码了不同的蛋白质,从而导致T7SSa和T7SSb会分泌不同的效应蛋白,进而发挥不同的生理功能。因此,为了更全面地认识T7SS,下文主要围绕T7SSa(以结核分枝杆菌作为代表菌株)和T7SSb(以金黄色葡萄球菌作为代表菌株)这两类T7SS的效应蛋白分别展开讨论(见表 1、表 2)。
| Classification | Effector proteins | Function |
| WXG100 protein family[7-8] | ESAT-6(EsxA) | Interfere with the secretion of host cytokines; Help bacteria invade into host cells |
| CFP-10(EsxB) | Induce apoptosis in macrophages and inhibit phagosome maturation; | |
| Promote the formation of granulomas | ||
| Esp effector proteins | EspA, EspC, EspD[10-12] EspB[8] |
Act as chaperone proteins Insert and disrupt the host cell membrane, causing cells lysis |
| EspH, EspL[13-14] | Stabilize the structure of other effector proteins and assist in their secretion out of the cell | |
| PE-PPE protein family[15-16] | Stably embed in bacterial cell envelop, and aggregate to form pores through structural changes; | |
| Nutrient absorption; | ||
| Regulate the secretion of host cytokines or modulate macrophage apoptosis |
| Classification | Effector proteins | Function |
| Esx WXG100 protein family effector proteins |
EsxA,EsxB | Interfere with the host macrophage apoptosis pathway and mediate bacterial immune evasion with EsxB; |
| Enhance bacterial invasiveness, and induce abscess formation | ||
| Non-WXG100 protein family |
EsxC[20] | Involved in bacterial persistence and causing persistent abscesses |
| Esx effector proteins | EsxD | Function is unclear |
| LXG protein family-lap chaperone proteins |
LXG-Lap[21-22] | LXG proteins exert antibacterial toxin functions, participating in intraspecies competition of bacteria; |
| WXG100-like chaperone protein Lap assists in the secretion of LXG effector proteins out of the cell | ||
| TspA[23] | TspA exerts membrane depolarization toxicity through contact, helping Staphylococcus aureus gain an advantage in bacterial competition | |
| Other T7SSb-secreted effector proteins |
EsaD-EsaG-EsaE[24] TslA-TilA[22] |
Intraspecies competition of Staphylococcus aureus TslA exerts cytotoxicity by disrupting bacterial cell membranes through its N-terminal phospholipase domain |
正如前文所述,在结核分枝杆菌的5种T7SSa亚型中,针对ESX-1亚型的研究较多,因此,ESX-1亚型所分泌的效应蛋白的功能也得到了较为充分的研究(见表 1)。
其中,WXG100蛋白家族是由esx-1基因簇所编码的典型T7SSa效应蛋白,该家族成员均由约100个氨基酸组成,因中心区域具有保守的WXG(Try-X-Gly)氨基酸序列结构域而得名。在结核分枝杆菌中,WXG100蛋白家族包含ESAT-6 (EsxA)和CFP-10 (EsxB)2种效应蛋白。EsxA和EsxB以异源二聚体的形式分泌出胞,研究表明,二者分泌相互依赖。当抑制了EsxA或EsxB中任何一方的分泌时,另一方也无法分泌[6]。在功能上,EsxA和EsxB是结核分枝杆菌的重要毒力因子,通过干扰宿主细胞因子的分泌帮助结核分枝杆菌入侵宿主细胞,并在细胞内存活和繁殖;此外,它们还会诱导巨噬细胞的凋亡并抑制吞噬体的成熟,实现免疫逃逸[7-8],以上均是刺激肉芽肿形成的关键因素。与此同时,esx-1基因簇还编码了另一类ESX-1亚型所特有的效应蛋白:Esp蛋白(ESX-secretion associated proteins, Esp)。Esp蛋白一方面具有与上述效应蛋白类似的毒力,与结核分枝杆菌的致病性相关。比如:以单体形式分泌的EspB会通过其疏水结构插入并破坏宿主细胞的细胞膜,造成宿主细胞裂解[9]。另一方面,Esp蛋白还可以作为伴侣蛋白,稳定其他T7SSa效应蛋白的结构,帮助它们分泌出胞。比如:EspA[10]、EspC[11]和EspD[12]是分泌其他ESX-1亚型效应蛋白所必需的;EspH[13]辅助EspE和EspF的折叠和分泌;EspL也具有与EspH类似的伴侣蛋白功能等[14]。
此外,研究人员也从esx-5基因簇所编码的蛋白中发现了另一类具有重要功能的T7SSa效应蛋白:PE(proline-glutamic acid)-PPE(proline-proline-glutamic acid)蛋白家族。PE-PPE蛋白家族的成员因在N末端具有典型的P(Pro)-E(Glu)序列,或是P (Pro)-P (Pro)-E(Glu)序列而得名。在结构上,PE-PPE蛋白家族的成员通常具有跨膜结构,使得它们可以在转运出内膜后稳定地嵌入分枝杆菌酸层中,并通过自身结构的变化聚合形成孔道。PE-PPE蛋白所形成的孔道可帮助细菌跨膜时选择性地摄取小分子物质,例如脂肪酸、阳离子、阴离子等营养物质[15]。这对于结核分枝杆菌营养吸收至关重要。另一方面,PE-PPE蛋白也同样具有细菌毒力功能,它可以通过调控宿主细胞因子的分泌或调节巨噬细胞的凋亡,帮助结核分枝杆菌在宿主细胞内存活以及免疫逃逸[16]。
2.1.2 金黄色葡萄球菌T7SSb效应蛋白的多样性由于金黄色葡萄球菌T7SSb仅由单一的esx基因簇编码,因此相较于结核分枝杆菌T7SSa,其分泌的效应蛋白在数量上明显较少,但在结构和功能上却具有一定的相似性。比如:Esx效应蛋白可以细分为从属于WXG100蛋白家族的EsxA和EsxB,以及非WXG100蛋白家族的EsxC和EsxD。其中,金黄色葡萄球菌的EsxA和EsxB在结构上分别与结核分枝杆菌T7SSa中的EsxA和EsxB具有相似性,它们都同属于WXG100蛋白家族。但区别在于,结核分枝杆菌中的EsxA-EsxB以异源二聚体的形式分泌出胞,而在金黄色葡萄球菌中,EsxA、EsxB和EsxC蛋白自身均会形成同源二聚体[5],并且EsxA与EsxB的分泌也并不相互依赖。这也体现出T7SSa和T7SSb在效应蛋白分泌机制上的差异。EsxA是金黄色葡萄球菌T7SSb分泌的关键毒力蛋白,它能够干扰宿主巨噬细胞的凋亡途径,与EsxB一起介导细菌的免疫逃逸,增强细菌的侵袭力[17-18]。此外,EsxA和EsxB作为T细胞抗原,也被当作金黄色葡萄球菌疫苗的候选组分[19]。EsxC是另一种金黄色葡萄球菌Esx效应蛋白,它虽然在脓肿形成初期所发挥的作用较小,但与细菌持留和脓肿持续性密切相关[20]。EsxD也是Esx效应蛋白的一员,但其具体作用尚不明晰。
T7SSb的效应蛋白分类及功能具体如表 2所示。除了含有与T7SSa类似的效应蛋白类型以外,也有其所独有的效应蛋白。比如:LXG蛋白家族是由金黄色葡萄球菌T7SSb分泌的具有大型抗菌毒素功能的效应蛋白,主要参与金黄色葡萄球菌与其他细菌的相互作用。LXG蛋白家族的成员具有一个保守的N末端LXG(Leu-X-Gly)结构域,该结构域与蛋白的分泌有关;同时,它还具有一个可变的发挥毒素功能的C末端结构域[21]。在LXG蛋白分泌过程中,它会与2~3个WXG100样蛋白形成复合物,这些WXG100样伴侣蛋白被称为Lap(LXG-associated α-helical proteins)。伴侣蛋白与LXG蛋白的N末端结构域相互作用,帮助LXG蛋白经由essC基因所编码的EssC孔道分泌出胞[22]。近期通过定量蛋白质组学发现,另一种T7SSb效应蛋白TspA[23]也从属于LXG蛋白家族。TspA C末端的跨膜结构使其可以在被分泌出胞后直接定位到其他细菌的细胞膜上,使细胞膜去极化而导致细菌死亡,从而帮助金黄色葡萄球菌在种内竞争中取得优势。但目前仍未明确Lap伴侣蛋白具体有哪些种类和功能。
除了以上两类之外,T7SSb还具有一些发挥着重要功能的效应蛋白。比如:形成毒素-抗毒素系统的EsaD和EsaE,二者在EsaE的帮助下形成稳定的复合物,并经由EsaE引导至EssC所形成的孔道分泌出胞。其中,EsaD是一种核酸酶毒素,参与金黄色葡萄球菌的种内竞争[24]。与此同时,近期有研究发现另一种T7SSb效应蛋白TslA也是一种由T7SSb分泌的菌间毒素,它通过其N末端的磷脂酶结构域破坏细菌细胞膜而发挥细胞毒性,实现对TslA敏感型菌株的杀伤[22]。同时,tslA基因毗邻多个tilA基因拷贝,后者所编码的蛋白具有抗TslA功能,可保护细菌免受自身和其他细菌TslA的毒害作用。
2.2 T7SS效应蛋白的分泌机制不同类型的T7SS效应蛋白的转运机制较为保守,均由属于FtsK-SpoIIIE家族的ATP酶马达蛋白[25]介导,该蛋白在T7SSa和T7SSb中分别称为EccC和EssC。EccC/EssC是T7SS的保守成分之一,它是介导效应蛋白分泌的核心组件。EccC/EssC包含一个2次跨膜结构域、一个未知功能域(domain of unknown function, DUF)以及3个FtsK-SpoIIIE样ATP酶结构域。了解效应蛋白的分泌机制对于更好地认识效应蛋白的结构和功能具有重要的意义。
在信号肽识别层面,有研究表明目前已知的T7SSa分泌的效应蛋白均具有高度保守的Yxxx[D/E]基序。该基序已被证明发挥了“信号肽”功能,并与EsxB的C末端的7个残基组成“双重信号”,共同介导关键效应蛋白EsxA-EsxB复合物的分泌[26]。而金黄色葡萄球菌T7SSb分泌的效应蛋白之间在一级结构上并不含有类似的保守基序,故不存在典型的“信号肽”结构。但是,部分效应蛋白会在N末端形成螺旋-转角-螺旋结构域(通常包含WXG或LXG基序),而该结构域已被证明是蛋白二聚化和分泌所必需[25]。因此,对于分泌而言,与T7SSa效应蛋白具有明确的基序作为“信号肽”相比,T7SSb效应蛋白在结构上的相似性可能比在序列上的相似性更为重要。
在分泌方式层面,T7SSa和T7SSb的差异更为显著。针对T7SSa,研究人员根据效应蛋白分泌出胞的孔道不同,提出了2种较为成熟的分泌假想模型[27],即中心孔道模型和原生孔隙模型。前者蛋白从同一孔道出胞,而后者从不同孔道出胞:PE-PPE蛋白通过EccC四周的疏水孔道出胞,而WXG100蛋白则通过位于EccC中间位置的孔道出胞。此外,由于PE-PPE蛋白家族结构的特殊性,会嵌入分枝杆菌酸层中呈“导管样”,因此研究人员猜想并证明了它也具有跨膜运输底物的功能潜力[15]。T7SSa还存在EspG、EccA以及MycP三个与分泌相关的关键蛋白:EspG[28]和EccA[29]作为分子伴侣参与了效应蛋白的折叠和稳定;MycP是一种蛋白酶,对分泌后的效应蛋白进行加工使其能够进入宿主细胞并发挥作用[30]。对于T7SSb的效应蛋白,它们会与EssC的不同结构域相互作用,进而分泌出胞[3]。例如:EsxB和EsxC分别结合EssC的D2和D3区,而EsxA并不直接与EssC作用[EsxA在枯草芽孢杆菌[31]中被证明其分泌与FHA (forkhead-associated domain, FHA)结构域相关]。T7SSb也有类似于T7SSa中PE-PPE蛋白的跨膜结构,即膜蛋白EsaA[32]。EsaA作为T7SSb中唯一横跨整个细胞被膜的组分,呈现“针尖样”,也具有帮助T7SSb效应蛋白转运出胞并进一步递送至靶细胞的重要功能。
2.3 T7SS效应蛋白的基因转录调控方式在结核分枝杆菌T7SSa中,ESX-1亚型与关键效应蛋白EsxA和EsxB的分泌有关,因此esx-1基因簇的转录调控机制备受关注。esx-1基因簇的基因转录水平受到多层调节。其中,双组分信号转导系统[33](two-component signal transduction systems, TCSs)可以通过感应环境条件的变化,进而调控其下游编码效应蛋白的基因转录水平。这种方式主要经由位于esx-1基因簇上游的espACD操纵子发挥作用。以PhoPR双组分信号转导系统为例[34]:位于细胞膜上的组氨酸激酶PhoR感应到环境变化(例如吞噬体中的酸性环境),从而自身磷酸化并将磷酸基团转移至相应的转录调节蛋白PhoP。磷酸化的PhoP通过上调esx-1上游espACD操纵子的转录水平,从而促进T7SSa效应蛋白的基因转录。另一种TCS MprAB以及其他调控因子EspR、CRP和Lsr2,也对编码T7SSa效应蛋白的基因转录具有调节功能[35-36]。此外,T7SSa的效应蛋白多为毒力蛋白。为了避免由分泌系统的分泌能力不足造成毒力蛋白在细胞内积累过多,从而对细菌自身产生毒害作用,T7SSa还会通过转录因子WhiB6所介导的负反馈调控机制,自动调整编码效应蛋白的基因的转录水平[37]。
T7SSa其他亚型(ESX-2~ESX-5)的研究较少,但弄清楚它们的基因转录调节也同样具有重要意义。比如:在缺乏磷酸盐的条件下,结核分枝杆菌可通过Pst/SenX3-RegX3系统上调esx-5基因簇的基因转录水平,而ESX-5表达的增加有助于细菌在宿主细胞内的生存和复制,这与该菌在不同环境条件下的适应性有关[38]。
在含T7SSb的细菌中,也具有多种信号通路,能够发挥调控其效应蛋白基因转录水平的作用。总体而言,可以分为σB依赖型调控通路和非σB依赖型调控通路。前者效应蛋白的基因转录水平由σB因子主导调控,并与全局调节因子arlR、spoVG、agr呈正相关,与调节因子sarA呈负相关。对于后者,效应蛋白的基因转录水平不受σB因子调控。例如:TCS SaeRS等双组分信号转导系统可以独立地接收并处理来自环境的信号,实现对下游编码T7SSb效应蛋白的基因的调控[39]。除了基因层面的调控方式之外,T7SSb效应蛋白还会对外界环境变化产生响应。近期研究人员发现,宿主的血清、鼻腔分泌物、肺表面活性剂中均含有能够刺激T7SSb分泌的活性成分,并成功鉴定其为“顺式不饱和脂肪酸”,可通过掺入金黄色葡萄球菌的细胞膜以降低细菌细胞膜的流动性,而膜动力学的改变可引起T7SSb活化[40]。但目前对T7SSb活化机理的研究较少,仍有待进一步揭示。
3 小结与展望随着对革兰氏阳性菌T7SS及其所分泌的效应蛋白研究的不断推进,从放线菌门到厚壁菌门,研究对象的范围逐渐扩大;从结构研究到功能研究,研究内容不断加深。相较于最早研究的T7SSa,T7SSb的发现较晚,有待更深入的研究。
其一,发现T7SSb的潜在效应蛋白有助于更完整地认识T7SSb。T7SSa可以通过蛋白之间的保守基序发现潜在的效应蛋白,但目前已知的T7SSb效应蛋白之间并不存在序列相似性,因此无法从序列层面直接筛选,这无疑增加了新蛋白的发现难度。但是,正如前文中所提示,改变外界环境条件会刺激T7SSb已知效应蛋白的分泌[40],因而通过改变环境条件很可能是发现新蛋白的一个契机。此外,结构层面的相似性也是未来可以考虑研究的方向。虽然序列层面差异较大,但从结构入手,很有可能实现类似T7SSa中以分泌基序为基础的分泌系统的“工程化”[41],从而将T7SS塑造成一种“可人为操控的分泌装置”。这在未来具有较为广阔的应用前景。
其二,T7SS所分泌的效应蛋白大多为毒力蛋白,因此若能抑制这些蛋白的分泌,对实现致病菌“减毒”具有重大意义。在T7SSa研究中已提出Esp类底物有成为“伴侣蛋白”的能力,并在此基础上提出将此作为药物靶点的巨大潜力。而在T7SSb研究中并未出现“通用伴侣”的相关报道,抑或是明确药物靶点的研究,而这些方面的研究也具有潜在的应用价值。
综上所述,对T7SSa和T7SSb的研究可以相互参考和借鉴。从效应蛋白多样性角度看分泌系统功能的多样性,对于更完整地认识这个仅革兰氏阳性菌具有的蛋白分泌系统T7SS,具有重要的理论和应用价值。
| [1] |
Andersen P, Andersen AB, Sorensen AL, Nagai S. Recall of long-lived immunity to Mycobacterium tuberculosis infection in mice[J]. J Immunol, 1995, 154: 3359-3372.
[DOI]
|
| [2] |
Harboe M, Oettinger T, Wiker HG, Rosenkrands I, Andersen P. Evidence for occurrence of the ESAT-6 protein in Mycobacterium tuberculosis and virulent Mycobacterium bovis and for its absence in Mycobacterium bovis BCG[J]. Infect Immun, 1996, 64: 16-22.
[DOI]
|
| [3] |
Abdallah AM, Pittius NCGV, Champion DG, Cox J, Luirink J, Vandenbroucke-Grauls CMJE, Appelmelk BJ, Bitter W. Type Ⅶ secretion—mycobacteria show the way[J]. Nat Rev Microbiol, 2007, 5(11): 883-891.
[DOI]
|
| [4] |
Newton-Foot M, Warren RM, Sampson SL, Van Helden PD, Claudius GVPN. The plasmid-mediated evolution of the mycobacterial ESX (Type Ⅶ) secretion systems[J]. BMC Evol Biol, 2016, 16: 62.
[DOI]
|
| [5] |
Bowman L, Palmer T. The type Ⅶ secretion system of Staphylococcus[J]. Annu Rev Microbiol, 2021, 75: 471-494.
[DOI]
|
| [6] |
Anes E, Pires D, Mandal M, Azevedo-Pereira JM. ESAT-6 a major virulence factor of Mycobacterium tuberculosis[J]. Biomolecules, 2023, 13(6): 968.
[DOI]
|
| [7] |
Bao Y, Wang L, Sun J. A small protein but with diverse roles: a review of EsxA in mycobacterium-host interaction[J]. Cells, 2021, 10(7): 1645.
[DOI]
|
| [8] |
Sun J, Champion PA, Bigi F. Editorial: cellular and molecular mechanisms of Mycobacterium tuberculosis virulence[J]. Front Cell Infect Microbiol, 2019, 9: 331.
[DOI]
|
| [9] |
Sengupta N, Padmanaban S, Dutta S. Cryo-EM reveals the membrane-binding phenomenon of EspB, a virulence factor of the mycobacterial type Ⅶ secretion system[J]. J Biol Chem, 2023, 299(4): 104589.
[DOI]
|
| [10] |
Chen JM, Zhang M, Rybniker J, Basterra L, Dhar N, Tischler AD, Pojer F, Cole ST. Phenotypic profiling of Mycobacterium tuberculosis EspA point mutants reveals that blockage of ESAT-6 and CFP-10 secretion in vitro does not always correlate with attenuation of virulence[J]. J Bacteriol, 2013, 195(24): 5421-5430.
[DOI]
|
| [11] |
Guo Q, Bi J, Wang H, Zhang X. Mycobacterium tuberculosis ESX-1-secreted substrate protein EspC promotes mycobacterial survival through endoplasmic reticulum stress-mediated apoptosis[J]. Emerg Microbes Infect, 2021, 10(1): 19-36.
[DOI]
|
| [12] |
Chen JM, Boy-Röttger S, Dhar N, Sweeney N, Buxton RS, Pojer F, Rosenkrands I, Cole ST. EspD is critical for the virulence-mediating ESX-1 secretion system in Mycobacterium tuberculosis[J]. J Bacteriol, 2012, 194(4): 884-893.
[DOI]
|
| [13] |
Phan TH, van Leeuwen LM, Kuijl C, Ummels R, van Stempvoort G, Rubio-Canalejas A, Piersma SR, Jiménez CR, van der Sar AM, Houben ENG, Bitter W. EspH is a hypervirulence factor for Mycobacterium marinum and essential for the secretion of the ESX-1 substrates EspE and EspF[J]. PLoS Pathog, 2018, 14(8): e1007247.
[DOI]
|
| [14] |
Sala C, Odermatt NT, Soler-Arnedo P, Gülen MF, von Schultz S, Benjak A, Cole ST. EspL is essential for virulence and stabilizes EspE, EspF and EspH levels in Mycobacterium tuberculosis[J]. PLoS Pathog, 2018, 14(12): e1007491.
[DOI]
|
| [15] |
Wang Q, Boshoff HIM, Harrison JR, Ray PC, Green SR, Wyatt PG, Barry CE 3rd. PE/PPE proteins mediate nutrient transport across the outer membrane of Mycobacterium tuberculosis[J]. Science, 2020, 367(6482): 1147-1151.
[DOI]
|
| [16] |
樊博, 王巍, 程小星. 结核分枝杆菌PE和PPE家族研究进展[J]. 国际呼吸杂志, 2011, 31(6): 454-457. [DOI]
|
| [17] |
Burts ML, Williams WA, DeBord K, Missiakas DM. EsxA and EsxB are secreted by an ESAT-6-like system that is required for the pathogenesis of Staphylococcus aureus infections[J]. Proc Natl Acad Sci USA, 2005, 102(4): 1169-1174.
[DOI]
|
| [18] |
Cao Z, Casabona MG, Kneuper H, Chalmers JD, Palmer T. The type Ⅶ secretion system of Staphylococcus aureus secretes a nuclease toxin that targets competitor bacteria[J]. Nat Microbiol, 2016, 2: 16183.
[DOI]
|
| [19] |
Bagnoli F, Fontana MR, Soldaini E, Mishra RP, Fiaschi L, Cartocci E, Nardi-Dei V, Ruggiero P, Nosari S, De Falco MG, Lofano G, Marchi S, Galletti B, Mariotti P, Bacconi M, Torre A, Maccari S, Scarselli M, Rinaudo CD, Inoshima N, Savino S, Mori E, Rossi-Paccani S, Baudner B, Pallaoro M, Swennen E, Petracca R, Brettoni C, Liberatori S, Norais N, Monaci E, Bubeck Wardenburg J, Schneewind O, O'Hagan DT, Valiante NM, Bensi G, Bertholet S, De Gregorio E, Rappuoli R, Grandi G. Vaccine composition formulated with a novel TLR7-dependent adjuvant induces high and broad protection against Staphylococcus aureus[J]. Proc Natl Acad Sci U S A, 2015, 112(12): 3680-3685.
[DOI]
|
| [20] |
Kneuper H, Cao ZP, Twomey KB, Zoltner M, Jäger F, Cargill JS, Chalmers J, van der Kooi-Pol MM, van Dijl JM, Ryan RP, Hunter WN, Palmer T. Heterogeneity in ess transcriptional organization and variable contribution of the Ess/Type Ⅶ protein secretion system to virulence across closely related Staphylocccus aureus strains[J]. Mol Microbiol, 2015, 93(5): 928-943.
[DOI]
|
| [21] |
Klein TA, Pazos M, Surette MG, Vollmer W, Whitney JC. Molecular basis for immunity protein recognition of a type Ⅶ secretion system exported antibacterial toxin[J]. J Mol Biol, 2018, 430(21): 4344-4358.
[DOI]
|
| [22] |
Garrett SR, Mietrach N, Deme J, Bitzer A, Yang Y, Ulhuq FR, Kretschmer D, Heilbronner S, Smith TK, Lea SM, Palmer T. A type Ⅶ-secreted lipase toxin with reverse domain arrangement[J]. Nat Commun, 2023, 14(1): 8438.
[DOI]
|
| [23] |
Ulhuq FR, Gomes MC, Duggan GM, Guo M, Mendonca C, Buchanan G, Chalmers JD, Cao Z, Kneuper H, Murdoch S, Thomson S, Strahl H, Trost M, Mostowy S, Palmer T. A membrane-depolarizing toxin substrate of the Staphylococcus aureus type Ⅶ secretion system mediates intraspecies competition[J]. Proc Natl Acad Sci U S A, 2020, 117(34): 20836-20847.
[DOI]
|
| [24] |
Cao Z, Casabona MG, Kneuper H, Chalmers JD, Palmer T. The type Ⅶ secretion system of Staphylococcus aureus secretes a nuclease toxin that targets competitor bacteria[J]. Nat Microbiol, 2016, 2: 16183.
[DOI]
|
| [25] |
Wang S, Zhou K, Yang X, Zhang B, Zhao Y, Xiao Y, Yang X, Yang H, Guddat LW, Li J, Rao Z. Structural insights into substrate recognition by the type Ⅶ secretion system[J]. Protein Cell, 2020, 11(2): 124-137.
[DOI]
|
| [26] |
Daleke MH, Ummels R, Bawono P, Heringa J, Vandenbroucke-Grauls CM, Luirink J, Bitter W. General secretion signal for the mycobacterial type Ⅶ secretion pathway[J]. Proc Natl Acad Sci U S A, 2012, 109(28): 11342-11347.
[DOI]
|
| [27] |
Rivera-Calzada A, Famelis N, Llorca O, Geibel S. Type Ⅶ secretion systems: structure, functions and transport models[J]. Nat Rev Microbiol, 2021, 19(9): 567-584.
[DOI]
|
| [28] |
Ekiert DC, Cox JS. Structure of a PE-PPE-EspG complex from Mycobacterium tuberculosis reveals molecular specificity of ESX protein secretion[J]. Proc Natl Acad Sci U S A, 2014, 111(41): 14758-14763.
[DOI]
|
| [29] |
Crosskey TD, Beckham KSH, Wilmanns M. The ATPases of the mycobacterial type Ⅶ secretion system: structural and mechanistic insights into secretion[J]. Prog Biophys Mol Biol, 2020, 152: 25-34.
[DOI]
|
| [30] |
van Winden VJ, Ummels R, Piersma SR, Jiménez CR, Korotkov KV, Bitter W, Houben EN. Mycosins are required for the stabilization of the ESX-1 and ESX-5 Type Ⅶ secretion membrane complexes[J]. mBio, 2016, 7(5): e01471-16.
[DOI]
|
| [31] |
Mietrach N, Damián-Aparicio D, Mielich-Süss B, Lopez D, Geibel S. Substrate interaction with the EssC coupling protein of the type Ⅶb secretion system[J]. J Bacteriol, 2020, 202(7): e00646-19.
[DOI]
|
| [32] |
Dreisbach A, Hempel K, Buist G, Hecker M, Becher D, van Dijl JM. Profiling the surfacome of Staphylococcus aureus[J]. Proteomics, 2010, 10(17): 3082-3096.
[DOI]
|
| [33] |
Kundu M. The role of two-component systems in the physiology of Mycobacterium tuberculosis[J]. IUBMB Life, 2018, 70(8): 710-717.
[DOI]
|
| [34] |
Fortune SM, Jaeger A, Sarracino DA, Chase MR, Sassetti CM, Sherman DR, Bloom BR, Rubin EJ. Mutually dependent secretion of proteins required for mycobacterial virulence[J]. Proc Natl Acad Sci U S A, 2005, 102(30): 10676-10681.
[DOI]
|
| [35] |
Pang X, Samten B, Cao G, Wang X, Tvinnereim AR, Chen XL, Howard ST. MprAB regulates the espA operon in Mycobacterium tuberculosis and modulates ESX-1 function and host cytokine response[J]. J Bacteriol, 2013, 195(1): 66-75.
[DOI]
|
| [36] |
Blasco B, Chen JM, Hartkoorn R, Sala C, Uplekar S, Rougemont J, Pojer F, Cole ST. Virulence regulator EspR of Mycobacterium tuberculosis is a nucleoid-associated protein[J]. PLoS Pathog, 2012, 8(3): e1002621.
[DOI]
|
| [37] |
Bosserman RE, Nguyen TT, Sanchez KG, Chirakos AE, Ferrell MJ, Thompson CR, Champion MM, Abramovitch RB, Champion PA. WhiB6 regulation of ESX-1 gene expression is controlled by a negative feedback loop in Mycobacterium marinum[J]. Proc Natl Acad Sci U S A, 2017, 114(50): E10772-E10781.
[DOI]
|
| [38] |
Elliott SR, Tischler AD. Phosphate starvation: a novel signal that triggers ESX-5 secretion in Mycobacterium tuberculosis[J]. Mol Microbiol, 2016, 100(3): 510-526.
[DOI]
|
| [39] |
Jenul C, Horswill AR. Regulation of Staphylococcus aureus virulence[J]. Microbiol Spectr, 2018, 7(2).
[DOI]
|
| [40] |
Lopez MS, Tan IS, Yan D, Kang J, McCreary M, Modrusan Z, Austin CD, Xu M, Brown EJ. Host-derived fatty acids activate type Ⅶ secretion in Staphylococcus aureus[J]. Proc Natl Acad Sci U S A, 2017, 114(42): 11223-11228.
[DOI]
|
| [41] |
Champion PA, Stanley SA, Champion MM, Brown EJ, Cox JS. C-terminal signal sequence promotes virulence factor secretion in Mycobacterium tuberculosis[J]. Science, 2006, 313(5793): 1632-1636.
[DOI]
|
 2024, Vol. 19
2024, Vol. 19


