结核病由结核分枝杆菌(Mycobacterium tuberculosis, M. tb)感染引起,主要通过气溶胶等途径传播[1-2]。目前,结核病仍然是严重危害人类健康的重大慢性传染性疾病,全球约四分之一的人口感染了结核分枝杆菌[3-4]。我国作为结核病高负担国家,新发病例数位居全球前列[4]。除了活动性结核病,全球还有大量的结核潜伏感染(latent tuberculosis infection, LTBI)者,大约5%~10%的LTBI感染者可进展为活动性结核病[5-6],是活动性结核病的巨大“储库”。唯一获得许可的卡介苗(Bacillus Calmette-Guerin vaccine, BCG)仅能预防儿童肺结核,无法预防成人肺结核,并且提供的保护作用随着时间的推移(免疫接种后约15年)而减弱[7],免疫缺陷患者接种有较大的风险。此外,耐多药和广泛耐药结核分枝杆菌菌株的出现,也给结核病的控制工作带来了巨大挑战,亟须研发更有效的结核病防控策略和技术。
宿主导向疗法(host-directed therapy, HDT)是一种通过药理学增强内源性宿主免疫系统对抗M. tb感染的新辅助治疗方案。以宿主为导向探索新的药物靶点,利用机体强大的自我治愈能力,如通过增强自噬或其他巨噬细胞效应机制,促进抗菌肽的产生,改变导致肺部炎症和基质破坏的特定机制,从而缩短结核病治疗的持续时间,预防耐药现象的产生,减少肺部病理损伤等[8-10]。
G蛋白偶联受体(G protein-coupled receptors, GPCR)是药物最重要、研究最深入的靶点之一,包括趋化因子受体、脂质受体、游离脂肪酸受体和孤儿受体等,能够调控重要的细胞过程(如免疫反应、炎症调节、凋亡、细胞增殖、迁移和分化),在机体发育、免疫功能调节、代谢功能调控中发挥着重要作用。近年来,有部分研究揭示GPCR在M. tb感染中具有重要的保护性作用。例如,趋化因子受体CCR2缺失导致小鼠巨噬细胞募集缺陷,与野生型小鼠比较,M. tb感染后缺陷小鼠肺中荷菌量增加且会过早死亡[11-12];CCR5启动子多态性与中国汉族人群肺结核的易感性、结核病进展及复发有关[13];与野生型小鼠相比,M. tb感染后CCR5缺陷小鼠在肺引流淋巴结中具有较高的M. tb荷菌量[14]。这些研究均提示,GPCR在抗结核感染中具有保护性作用。
GPR84为游离脂肪酸受体,游离脂肪酸能够维持细胞重要的生理功能,为细胞提供能量、合成膜脂质及参与脂质代谢等[15-17]。脂多糖(lipopolysaccharide, LPS)等炎症刺激后Gpr84表达明显上调[18]。分枝杆菌细胞壁中含有丰富的糖脂化合物,是激活GPR84的有效配体,且脂肪酸代谢在分枝杆菌致病过程中发挥着重要作用。GPR84主要在肺、骨髓中固有免疫细胞上表达,包括单核细胞、巨噬细胞、中性粒细胞等[18-20]。有研究发现,GPR84的激活与缺失影响了巨噬细胞的功能。在小鼠和人巨噬细胞系中,LPS和其他促炎分子处理后,GPR84在mRNA水平表达增加,促炎因子[肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)、白细胞介素(Interleukin, IL)-6, IL-12、趋化因子(C-C基序)配体2(chemokine (C-C motif) ligand 2,CCL2)等]表达水平上调[21],敲除Gpr84后,多种促炎因子IL-1β、IL-6和TNF-α等的表达下调[22],且GPR84活化增强了巨噬细胞对细菌的黏附和吞噬作用[21]。通过查阅GEO Profiles中相关芯片数据发现,M. tb感染小鼠的肺组织中Gpr84表达同样显著上调。但是,目前关于GPR84在分枝杆菌感染过程中的具体作用尚不清楚,为了探究GPR84在分枝杆菌感染过程中的功能,本研究拟以Gpr84基因缺陷C57BL/6小鼠和野生型小鼠为研究对象,用牛分枝杆菌卡介苗菌株雾化感染小鼠以构建小鼠分枝杆菌感染模型,评价Gpr84缺失对小鼠控制BCG感染效应的影响,旨在为建立宿主导向疗法提供科学依据。
1 材料和方法 1.1 实验材料 1.1.1 实验动物本实验采用6~8周龄、SPF级C57BL/6小鼠。野生型C57BL/6小鼠种鼠购自上海吉辉实验动物有限公司,Gpr84基因缺陷小鼠为C57BL/6背景,种鼠由华东师范大学生命科学院杜冰教授课题组惠赠。小鼠饲养繁育于上海市公共卫生临床中心动物中心(SPF级)。所有实验设计及操作均符合动物福利伦理要求,并通过了上海市公共卫生临床中心动物伦理委员会伦理审批(公卫伦审[2020]2020-A061 02号)。
1.1.2 实验菌株本实验所用BCG-Paster菌株由上海市公共卫生临床中心结核病研究中心保存。
1.1.3 主要试剂7H9、7H10、OADC增菌液(BD,美国);RPMI 1640、PBS溶液(Hyclone,美国);胎牛血清(fetal bovine serum,FBS)、100×青-链霉素、Collagenase IV(Gibco,美国);DNase I(Roche,瑞士);红细胞裂解液、DAB试剂盒(碧云天,中国上海); TIANamp Genomic DNA Kit组织DNA提取试剂盒、2×Pfu PCR Master Mix(天根,中国北京);通用型组织固定液(爱必信,中国上海);Tween-80、牛血清白蛋白(bovine serum albumin, BSA)、卡那霉素、两性霉素B、羧苄西林、多粘菌素B、甲氧苄啶(Sigma,美国);DL2000 Marker(Takara,日本);GPR84抗体(Affinity,澳大利亚);HRP标记的山羊抗兔IgG(康为世纪,中国江苏);Fixable Viability Dye、Anti-Mouse CD45、CD11b、CD11c、CD170、CD64、Ly-6C、LY-6G(eBioscience,美国);Anti-mouse CX3CR1(BioLegend,美国)。
1.1.4 主要设备生物安全柜(海尔,中国山东);细菌培养箱、CO2细胞培养箱、微量分光光度计(Thermo Fisher,美国);高速离心机、分光光度计(Eppendorf,德国);恒温摇床(知楚,中国上海);全自动样品快速研磨仪(净信,中国上海);全自动细胞计数仪、聚合酶链反应(polymerase chain reaction,PCR)扩增仪(Bio-Rad,美国);流式细胞分析仪(BD LSRFortessa,美国);凝胶成像系统(Major Science,美国);石蜡包埋机、切片机(Lecia,德国)。
1.2 实验方法 1.2.1 Gpr84敲除小鼠基因组鉴定使用TIANamp Genomic DNA Kit组织DNA提取试剂盒提取鼠尾DNA,进行普通PCR扩增,PCR反应程序如下:95 ℃预变性30 s;94 ℃ 30 s,58 ℃ 1 min,72 ℃ 30 s,35个循环;72 ℃ 10 min,10 ℃保存。Gpr84引物序列:5’-AGGCCTGAGAATCTTTGTGAGCTA-3’,3’-GCCGGTACGCCAATGGAG-5’。扩增产物经1%琼脂糖凝胶电泳检测和证实。
1.2.2 小鼠BCG感染模型的建立将打好耳标的两组小鼠(每组各42只)放入提前高压灭菌好的雾化装置中,向雾化杯中加入3 mL BCG(约1×109 CFU)菌液,关闭雾化笼盖,雾化10 min,并沉降10 min。30 min后处死每组各2只小鼠确定初始感染菌量,具体操作如下:摘取肺脏放入装有1 mL预冷无菌PBS及适量1.2 mm钢珠的匀浆螺纹管中,组织研磨仪设置70 Hz 90 s,匀浆2次;梯度稀释肺匀浆液,吸取合适梯度稀释液100 μL滴于已加入少许2 mm玻璃珠的7H11固体平板上(含10% OADC增菌液及4种抗生素,两性霉素B4 μg/mL、羧苄西林50 μg/mL、甲氧苄啶2 μg/mL、多粘菌素B40 U/mL)摇晃均匀;37 ℃培养20天后计数,获得实际感染的CFU。
1.2.3 小鼠体重称量及观察一般情况感染后每周固定时间称量并记录小鼠体重;观察感染后每周小鼠一般情况变化(包括进食量、活跃度、行为状态及毛发情况等)。
1.2.4 BCG感染后小鼠肺组织GPR84表达检测感染6 w后处死小鼠,摘取小鼠肺脏用4%多聚甲醛固定,进行脱水、石蜡切片,于5% BSA室温孵育1 h封闭非特异性抗原位点;滤纸吸去封闭液后滴加兔抗小鼠GPR84一抗平放于湿盒内4 ℃孵育过夜;PBS洗涤2次,滴加山羊抗兔HRP标记二抗,37 ℃孵育1 h;PBS洗涤2次,避光滴加DAB显色20 min,自来水冲洗;苏木素溶液染色封片后显微镜观察分析。
1.2.5 小鼠脏器荷菌量的检测分别于感染后2 w、4 w、6 w、8 w、12 w等不同时间点处死小鼠,摘取小鼠肺脏、脾脏、肝脏和肾脏,放入装有预冷无菌PBS及钢珠的匀浆螺纹管中,进行组织研磨;组织研磨仪设置70 Hz 90 s,肺匀浆2个循环,脾脏、肝脏和肾脏1个循环;梯度稀释肺匀浆液,吸取合适梯度稀释液100 μL滴于7H11固体平板上摇晃均匀,37 ℃培养20天后计数CFU。并取左下叶肺组织用4%多聚甲醛固定,进行脱水、石蜡切片,苏木素-伊红(hematoxylin-eosin,HE)染色和抗酸染色,于显微镜观察分析。
1.2.6 小鼠肺实质细胞提取取每只小鼠肺组织分别放置于6孔板对应各孔中,手术剪剪碎,加入适量消化液(RPMI 1640培养基含10%FBS、100 U/mL青霉素、100 μg/mL链霉素及100 μg/mL DNase I和1 mg/mL Collagenase IV)转移至15 mL离心管中,每管液体补齐至10 mL,37 ℃摇床消化45 min;消化后的肺组织经70 μm滤器过滤转移至50 mL离心管中,4 ℃ 600 g离心5 min;弃上清液,加入5 mL红细胞裂解液裂解5 min,5 mL RPMI 1640完全培养基终止反应,4 ℃ 600 g离心5 min;10 mL RPMI 1640完全培养基重悬洗涤1~2次,最后2~3 mL RPMI 1640完全培养基重悬,进行细胞计数。
1.2.7 流式细胞术检测小鼠肺组织髓系细胞群根据细胞计数结果每样取1×106细胞,PBS补齐至200 μL,室温600 g离心5 min,PBS洗2遍;每孔加入100 μL 1∶1 000稀释后的死活染料标记细胞死活,空白对照用200 μL PBS重悬细胞,4 ℃避光孵育30 min;每孔加入100 μL P2F(PBS+2%FBS)终止死活染色,室温600 g离心5 min沉淀细胞,去除上清液;200 μL P2F重悬洗涤1~2次;100 μL FcR阻断试剂重悬细胞,4 ℃孵育15 min;离心去除上清液后,全染孔加入100 μL表面抗体混合物重悬细胞;单阳对照分别单独加入100 μL P2F及相应浓度抗体,空白对照用P2F重悬细胞,4 ℃避光孵育30 min;每孔加入100 μL P2F终止表面染色,室温600 g离心5 min沉淀细胞,去除上清液;200 μL P2F重悬细胞,室温600 g离心5 min,洗涤1~2次;最后200 μL P2F重悬细胞,并通过滤网转移至专用上机流式管中上机收集2×105个细胞/样;流式细胞分析仪:BD LSRFortessa;使用Flowjo V10软件进行数据分析,结果以百分比表示。
1.3 统计学分析方法使用Graphpad Prism 9.0及Excel统计分析数据,所得实验数据均采用平均值±标准差的形式表示,N=3~10,两组间比较采用Student’s t检验,多组间比较采用方差分析,P < 0.05代表差异有统计学意义。*P < 0.05,**P < 0.01,***P<0.001,****P < 0.000 1。
2 实验结果 2.1 小鼠高剂量BCG模型的建立使用高剂量BCG(3 mL BCG菌液约含1×109 CFU)雾化感染C57BL/6小鼠,建立小鼠BCG感染模型,雾化完成30 min后每组小鼠各处死2只取肺组织匀浆梯度稀释,涂板确认小鼠感染成功。CFU结果显示,每只小鼠实际雾化吸入初始菌量约4 000 CFU。
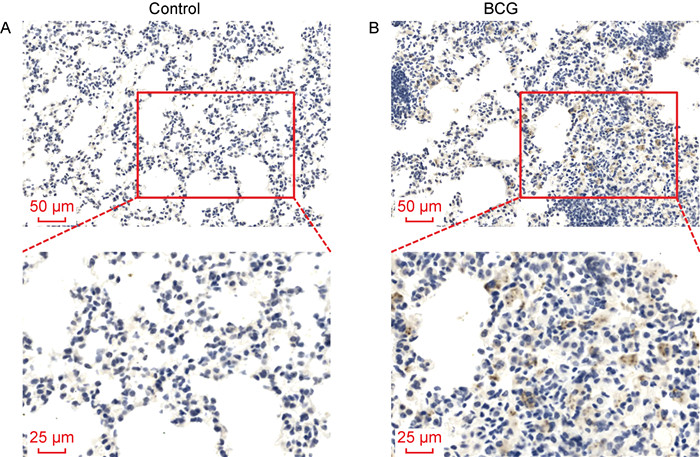
2.2 GPR84在BCG感染后的小鼠肺组织上表达上调BCG感染小鼠6周后摘取C57BL/6小鼠肺组织进行免疫组化染色,证实BCG感染后小鼠肺组织中GPR84表达上调(见图 1)。
|
| 图 1 小鼠感染BCG后GPR84在其肺组织上表达上调 Fig. 1 Up-regulation of GPR84 expression in the lung tissue of mice infected with BCG |
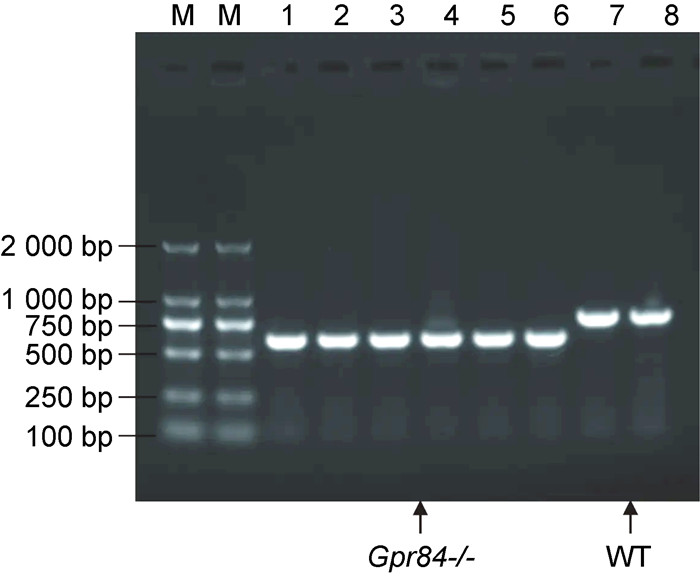
为了进一步探究GPR84在分枝杆菌感染过程中的作用,将野生型C57BL/6小鼠(WT组)和Gpr84基因缺陷小鼠(C57BL/6背景,Gpr84-/-组)作为对照建立高剂量BCG感染小鼠模型。Gpr84基因缺陷小鼠通过剪尾提取gDNA鉴定,电泳结果如图 2所示,Gpr84-/-组条带610 bp,略低于WT组条带。
|
| 图 2 Gpr84基因敲除小鼠鉴定结果 Fig. 2 Identification of Gpr84 knockout mice |
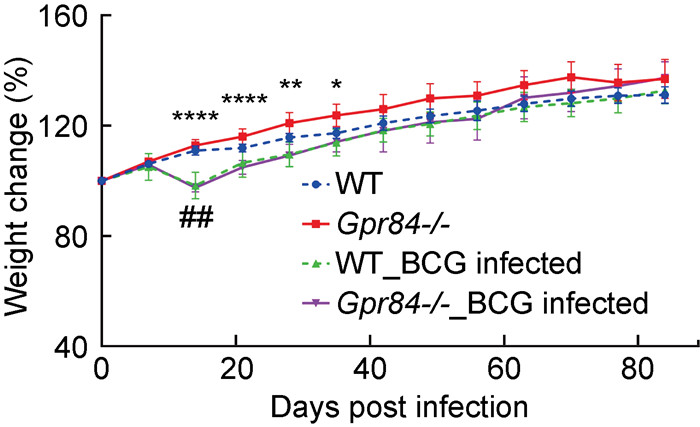
由于分枝杆菌感染是慢性消耗性疾病,且GPR84属于游离脂肪酸受体,与机体代谢密切相关,通过连续跟踪12周未感染和感染后同窝、同性别、出生日期和初始体重相近的4组小鼠在发育过程中的体重变化,发现未感染时,WT组小鼠和Gpr84-/-组小鼠体重无明显差异(见图 3);感染BCG后,Gpr84-/-组相较未感染时体重有明显下降,尤其在感染早期(P < 0.000 1),而WT组在感染BCG后仅在第14天时较未感染时有轻微体重下降(P < 0.01),其余时间无明显差异(见图 3)。除外体重下降外,两组小鼠在感染后均出现食量减低、活跃度下降等现象。
|
| *代表Gpr84-/-组与Gpr84-/-_BCG infected组之间的差异具有显著性;#代表WT组与WT_BCG infected组之间的差异具有显著性。 *Represents a significant difference between Gpr84-/- group and Gpr84-/-_BCG infected group; # represents a significant difference between WT group and WT_BCG infected group. 图 3 各组小鼠体重随时间的变化情况(N≥10) Fig. 3 Weight changes of mice in each group over time (N≥10) |
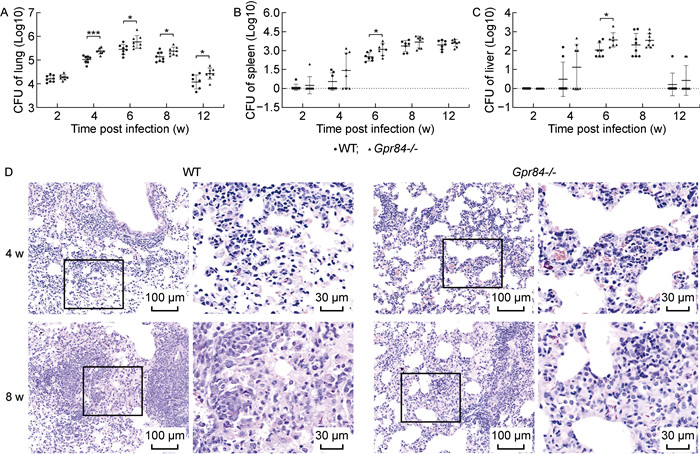
在感染后2 w、4 w、6 w、8 w、12 w等不同时间点处死小鼠,将肺脏、脾脏、肝脏和肾脏匀浆梯度稀释涂板,37 ℃培养20天后进行CFU计数,发现在感染后4 w,Gpr84-/-组肺荷菌量明显高于WT组(P < 0.001,见图 4A),后6 w、8 w至12 w时两组小鼠肺组织荷菌量差异逐渐减小(P < 0.05,见图 4 A);脾脏和肝脏中荷菌量的变化情况与肺中的趋势一致,但较肺脏荷菌量变化稍有滞后,4 w前有近一半小鼠脾脏、肝脏中未涂出CFU,6 w时Gpr84-/-组和WT组脾脏和肝脏中荷菌量有明显差异,Gpr84-/-组的荷菌量高于WT组(P < 0.05,见图 4B~C);肾脏中未检测出CFU。
|
| A~C: 两组小鼠肺、脾、肝脏CFU结果随BCG感染时间的变化;D: 两组小鼠肺组织抗酸染色结果随BCG感染时间的变化。 A-C: CFU changes in mouse lung, spleen and liver of the two groups with BCG infection; D: Changes of acid-fast staining results in mouse lung tissues of the two groups with BCG infection. 图 4 GPR84缺失削弱小鼠清除BCG的能力 Fig. 4 Deletion of GPR84 decreased the ability of removing BCG of mice |
小鼠肺组织抗酸染色也进一步证实,BCG感染后Gpr84-/-组小鼠肺组织中抗酸杆菌数量明显高于WT组,4周时差异最显著,与涂板CFU统计结果一致(见图 4D)。
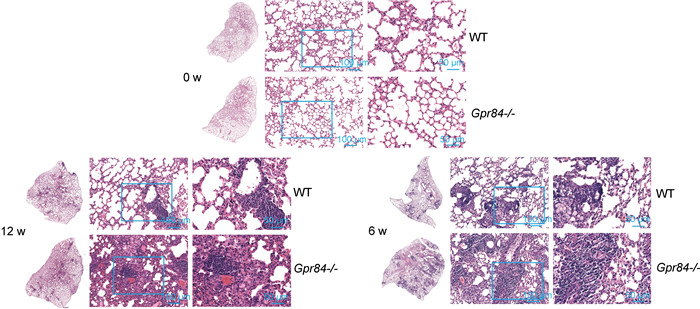
2.3.3 GPR84缺失加重BCG感染后小鼠肺部结构病理改变小鼠肺组织HE染色结果显示,BCG感染6 w时小鼠肺部病灶最多,正常肺泡结构损坏最严重,随后感染逐渐得到控制,非典型肉芽肿病灶逐渐减少,但肺部炎症仍较剧烈。Gpr84-/-组小鼠肺组织正常肺泡结构损坏明显较WT组严重,且病灶数多于WT组,呈大片融合状(见图 5),提示GPR84缺失可能加重BCG感染后小鼠肺部结构的病理改变。
|
| 图 5 GPR84缺失加重BCG感染小鼠的肺部结构病理改变 Fig. 5 Deletion of GPR84 aggravated the pulmonary histological lesions in mice infected with BCG |
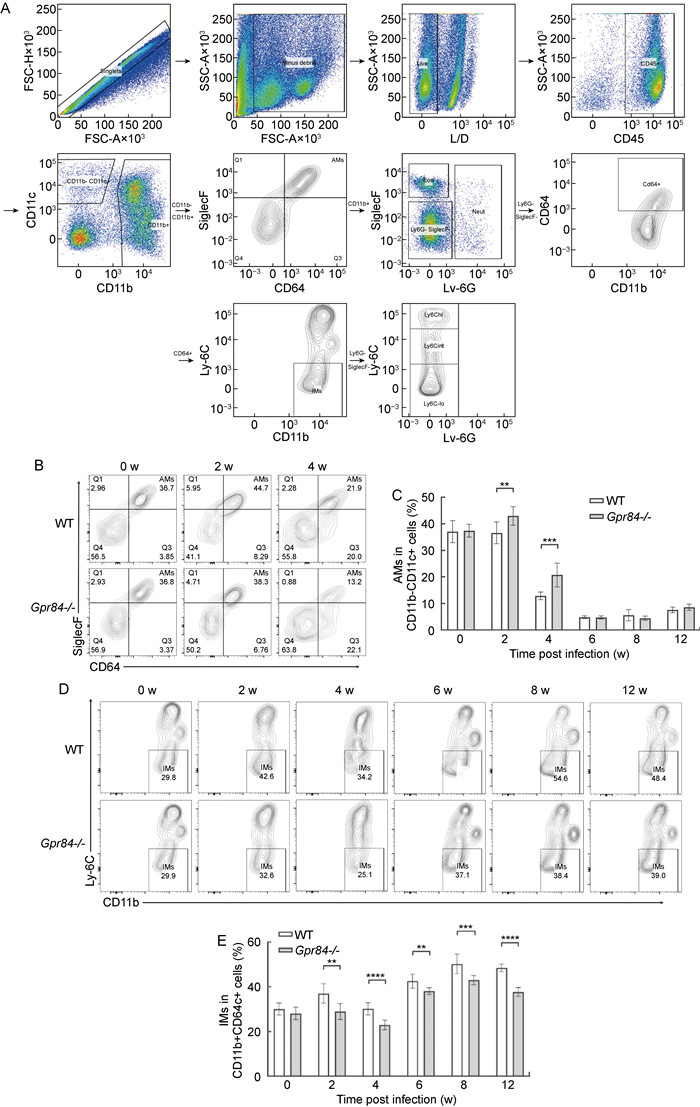
M. tb是一种兼性胞内致病菌,能在巨噬细胞内存活和复制。肺泡巨噬细胞(alveolar macrophages, AMs)和肺间质巨噬细胞(interstitial macrophages, IMs)是肺组织常驻巨噬细胞,是抵御外来细菌等病原体入侵的第一道防线,在维持肺中内环境稳态方面发挥着重要作用。通过分离两组小鼠肺细胞进行流式细胞术分析发现,AMs在BCG感染早期均迅速消耗减少,感染12 w时开始逐渐恢复,但数量仍较低(见图 6B~C)。IMs在感染早期稍有消耗,随即迅速恢复并呈高水平状态(见图 6D~E)。
|
|
A: 小鼠肺细胞群流式分析流程图;B~C: BCG感染后肺部AMs比例变化;D~E: BCG感染后肺部IMs比例变化。
A: Flow cytometry analysis of mouse lung cell population; B-C: Change of AMs proportion in lung after BCG infection; D-E: Change of IMs proportion in lung after BCG infection. AMs: CD11b-CD11c+ SiglecF+ CD64+; IMs: CD11b+ SiglecF-CD64+ Ly6C-. 图 6 小鼠肺部巨噬细胞亚群分析 Fig. 6 Analysis of macrophages subsets in mouse lung |
未感染时,Gpr84敲除对肺中常驻的AMs和IMs数量无明显影响,但随着BCG感染,两组小鼠常驻巨噬细胞群的比例发生偏移,急性感染时,Gpr84-/-组小鼠肺中AMs比例明显较WT组升高,而IMs比例较WT组明显降低(见图 6B~E)。因此,Gpr84敲除小鼠肺中CFU明显升高,肺组织病理损伤严重或与感染后肺组织常驻细胞群比例变化有极大关系。
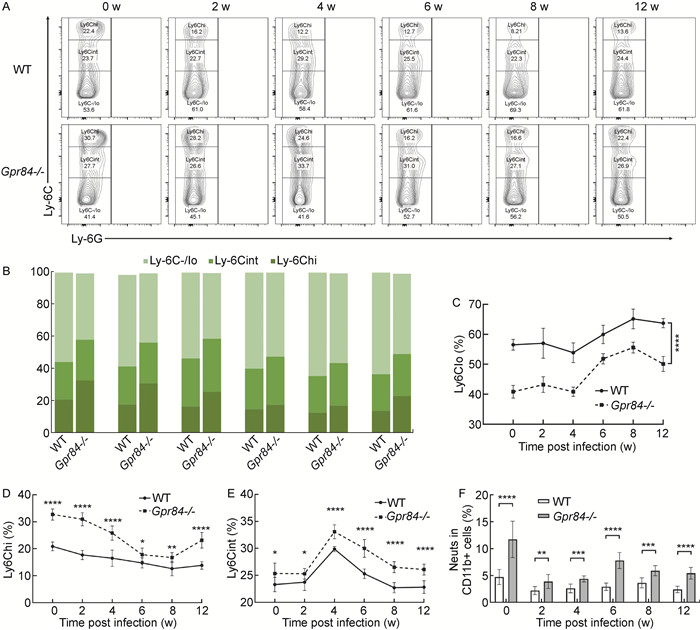
2.5 GPR84缺失影响小鼠肺组织单核吞噬细胞从Ly6Chi向Ly6Clo转化血液来源的单核吞噬细胞(mononuclear phagocytes, MNPs)是肺组织常驻IMs的重要补充来源,通过对小鼠肺部髓系细胞群中单核吞噬细胞进行亚群分析发现,两组小鼠肺中单核吞噬细胞亚群比例的变化趋势一致。随着BCG感染加重,Ly6Chi亚群比例逐渐降低,当细菌负荷降低感染逐渐得到控制时,Ly6Chi亚群比例逐渐回升;Ly6Cint单核吞噬细胞亚群比例随着BCG感染先升高后降低,BCG感染4周时,Ly6Cint亚群比例最高,后逐渐降低;而Ly6Clo单核吞噬细胞亚群在感染早期变化不大,感染4周时,快速升高;Gpr84-/-组小鼠肺细胞Ly6Chi亚群和Ly6Cint亚群比例高于WT组,而Ly6Clo亚群比例低于WT组(见图 7 A~E)。
|
|
A: 小鼠肺部单核吞噬细胞亚群;B: 单核吞噬细胞亚群比例分析;C~E: BCG感染后肺部单核吞噬细胞亚群比例变化;F: BCG感染后肺部Neuts比例变化。
A: MNPs subsets in mouse lung; B: Ratio of MNPs subsets; C-E: Change of MNPs proportion in lung after BCG infection; F: Change of Neuts proportion in lung after BCG infection. MNPs: CD11b+ SiglecF-Ly6G-Ly6C+/-; Neuts: CD11b+ Ly6G+. 图 7 小鼠肺部单核吞噬细胞亚群分析 Fig. 7 Analysis of mononuclear phagocyte subsets in mouse lung |
除外单核吞噬细胞亚群,Gpr84-/-组小鼠肺部中性粒细胞(neutrophils, Neuts)比例也高于WT组(见图 7F)。
3 讨论M. tb是一种兼性胞内致病菌,活化的巨噬细胞及相关细胞因子是控制M. tb的第一道防线,在感染M. tb的机体固有免疫应答中具有重要作用。目前研究发现,巨噬细胞主要通过Toll样受体、甘露糖受体、清道夫受体等模式识别受体识别、结合并吞噬M. tb[23],但是还有很多未知受体参与巨噬细胞与M. tb的相互作用。
GPCR是最大的膜受体蛋白家族,也是药物开发中最重要、研究最深入的靶点之一,已有研究表明GPCR在M. tb感染中具有重要的保护性作用[11-14],但GPR84在分枝杆菌感染过程中的调控作用尚不清楚。为了探究GPR84在分枝杆菌感染过程中的功能调控作用,本文通过BCG雾化感染GPR84缺陷小鼠和野生型小鼠,发现感染BCG后,Gpr84-/-组较于未感染时体重有明显下降;WT组仅在感染后第14天时较未感染时有轻微体重下降。此外,Gpr84-/-组小鼠组织中CFU数明显高于WT组,肺组织抗酸染色结果进一步显示,Gpr84-/-组小鼠肺组织病灶中密集成团的抗酸杆菌数量明显增多,也印证了这一结果。小鼠肺组织HE染色显示,Gpr84-/-组小鼠肺组织正常肺泡结构破坏较WT组更为严重,且病灶数多于WT组,呈大片融合状。高细菌负荷和更严重的病理损害提示,GPR84缺失可能加重分枝杆菌感染。
肺组织中有肺泡巨噬细胞和肺间质巨噬细胞2种常驻巨噬细胞。肺泡巨噬细胞被认为是气溶胶感染时吞噬M. tb的第一道防线[1]。研究表明,肺中常驻巨噬细胞存在异质性,在控制分枝杆菌感染及促进分枝杆菌传播扩散中发挥着截然不同的作用[24-26]。AMs中的分枝杆菌表现出比IMs中更低的应激水平和更高的细菌复制能力[24]。耗竭AMs后,小鼠肺中细菌负荷降低[24, 27],而IMs耗竭则增加了肺中细菌负荷[24],IMs/AMs的相对比例降低促进了细菌负荷的增加。也有研究报道,AMs通过吞噬M. tb将其从肺泡运输到肺间质,进一步促进了M. tb的传播扩散[28]。GPR84的缺失可能通过增加肺组织中AMs的数量,来削弱IMs加重细菌负荷及病理损害的影响。
本文通过分离小鼠肺细胞并进行流式细胞术分析发现,小鼠肺组织常驻AMs在BCG感染早期迅速消耗减少,而IMs稍有消耗即迅速更新恢复并呈高水平状态。未感染时,Gpr84敲除对肺中常驻AMs和IMs数量无明显影响,但在BCG急性感染时,Gpr84-/-组小鼠肺中AMs比例较于WT组明显升高,而IMs比例较于WT组明显降低。并且Gpr84敲除后小鼠肺中单核吞噬细胞Ly6Chi亚群比例增加,Ly6Clo亚群数量减少。随着BCG感染加重,两组小鼠肺部单核吞噬细胞Ly6C表达均逐渐减少,Ly6Chi亚群向Ly6Clo亚群转化。当细菌负荷降低、感染逐渐得到控制时,Ly6Chi亚群比例逐渐回升。与既有研究报道中小鼠M. tb感染后Ly6Chi单核细胞快速运输到肺部,分化成Ly6Clo亚群并留在肺血管空间的结论一致[29]。
中性粒细胞同样是M. tb感染后的重要应答细胞。有研究发现,在痰液、支气管肺泡灌洗液和肺结核腔内容物中,中性粒细胞是主要的细胞类型[30]。M. tb感染小鼠的研究与痰液、肺部样本中的发现一致[31]。本实验发现,Gpr84敲除后小鼠肺部中性粒细胞比例增加。但多项研究报道,大量的中性粒细胞浸润与免疫力下降,促进了细菌生长,加重了病理学损害、坏死,这与严重的M. tb感染以及加重疾病严重程度有关[31-33]。本文推测,GPR84缺失通过降低IMs/AMs的相对比例来影响MNPs亚型转换,增加了Neuts浸润,从而加重了肺组织细菌负荷和病理损伤。
本研究采用的小鼠BCG感染模型有诸多优点,BCG菌株经过多次传代自然减毒,毒力降低,对实验室等级要求不高,对于实验操作人员具有较强的安全性;且因M. tb在较多感染人群中呈潜伏感染状态,或初始急性感染后可被“限制”,直至免疫力较低时才重新激活[6]。而H37Rv等毒株的毒性较强,有研究发现,尽管低剂量感染后数月小鼠疾病进展缓慢,脏器中细菌负荷呈稳定状态,但最终仍屈服于疾病而死亡[34-36]。而BCG毒力较低,小鼠在急性感染后可自行控制,肺脾等脏器中细菌负荷逐渐降低,因此已有多项研究使用BCG菌株进行分枝杆菌感染免疫等[37-40],且结果表明BCG诱导的肉芽肿中髓系和淋巴细胞群在运动性和T细胞停滞方面与H37Rv诱导的肉芽肿行为相同[38]。
宿主导向治疗是一种新的结核病辅助治疗方法,其通过调节宿主免疫应答而非直接靶向病原体来对抗感染。与抗结核药物联合应用时,此疗法有助于增强药物疗效、缩短治疗时间、改善免疫病理损伤和减少耐药性的产生,具有广阔的发展前景。本研究创新性地探究了GPR84在分枝杆菌感染过程中的功能调控作用,为开发针对M. tb的有效治疗靶点提供了一些思路。然而,本研究仍存在一定的局限性:目前仅讨论了GPR84在分枝杆菌感染过程中的功能表型,未涉及深入的机制探讨;并且BCG作为减毒型牛分枝杆菌,缺乏ESAT6和CFP10等关键毒力因子,无法完全模拟小鼠感染M. tb菌株后的调控作用;在耐药性方面的研究,须运用耐药M. tb菌株建立耐药动物模型,未来有必要采用H37Rv或其他M. tb菌株进一步深入研究。
| [1] |
Philips JA, Ernst JD. Tuberculosis pathogenesis and immunity[J]. Annu Rev Pathol, 2012, 7: 353-384.
[DOI]
|
| [2] |
Turner RD, Chiu C, Churchyard GJ, Esmail H, Lewinsohn DM, Gandhi NR, Fennelly KP. Tuberculosis infectiousness and host susceptibility[J]. J Infect Dis, 2017, 216: S636-S643.
[DOI]
|
| [3] |
Houben RM, Dodd PJ. The global burden of latent tuberculosis infection: a re-estimation using mathematical modelling[J]. PLoS Med, 2016, 13(10): e1002152.
[DOI]
|
| [4] |
World Health Organization. Global tuberculosis report 2022[R]. Geneva: World Health Organization, 2022.
|
| [5] |
World Health Organization. WHO consolidated guidelines on tuberculosis: tuberculosis preventive treatment[R]. Geneva: World Health Organization, 2020.
|
| [6] |
Behr MA, Edelstein PH, Ramakrishnan L. Revisiting the timetable of tuberculosis[J]. BMJ, 2018, 362: k2738.
[DOI]
|
| [7] |
Dockrell HM, Smith SG. What have we learnt about BCG vaccination in the last 20 years?[J]. Front Immunol, 2017, 8: 1134.
[DOI]
|
| [8] |
Wallis RS, Hafner R. Advancing host-directed therapy for tuberculosis[J]. Nat Rev Immunol, 2015, 15(4): 255-263.
[DOI]
|
| [9] |
Shen J, Fu Y, Liu F, Liu F, Ning B, Jiang X. Ursolic acid promotes autophagy by inhibiting Akt/mTOR and TNF-α/TNFR1 signaling pathways to alleviate pyroptosis and necroptosis in Mycobacterium tuberculosis-infected macrophages[J]. Inflammation, 2023, 46(5): 1749-1763.
[DOI]
|
| [10] |
Pagán AJ, Lee LJ, Edwards-Hicks J, Moens CB, Tobin DM, Busch-Nentwich EM, Pearce EL, Ramakrishnan L. mTOR-regulated mitochondrial metabolism limits mycobacterium-induced cytotoxicity[J]. Cell, 2022, 185(20): 3720-3738.
[DOI]
|
| [11] |
Peters W, Scott HM, Chambers HF, Flynn JL, Charo IF, Ernst JD. Chemokine receptor 2 serves an early and essential role in resistance to Mycobacterium tuberculosis[J]. Proc Natl Acad Sci U S A, 2001, 98(14): 7958-7963.
[DOI]
|
| [12] |
Scott HM, Flynn JL. Mycobacterium tuberculosis in chemokine receptor 2-deficient mice: influence of dose on disease progression[J]. Infect Immun, 2002, 70(11): 5946-5954.
[DOI]
|
| [13] |
Liu S, Liu N, Wang H, Zhang X, Yao Y, Zhang S, Shi L. CCR5 promoter Polymorphisms associated with pulmonary Tuberculosis in a Chinese Han population[J]. Front Immunol, 2020, 11: 544548.
[DOI]
|
| [14] |
Algood HM, Flynn JL. CCR5-deficient mice control Mycobacterium tuberculosis infection despite increased pulmonary lymphocytic infiltration[J]. J Immunol, 2004, 173(5): 3287-3296.
[DOI]
|
| [15] |
Potter BJ, Sorrentino D, Berk PD. Mechanisms of cellular uptake of free fatty acids[J]. Annu Rev Nutr, 1989, 9: 253-270.
[DOI]
|
| [16] |
Houten SM, Violante S, Ventura FV, Wanders RJ. The biochemistry and physiology of mitochondrial fatty acid β-oxidation and its genetic disorders[J]. Annu Rev Physiol, 2016, 78: 23-44.
[DOI]
|
| [17] |
Pan Y, Tian T, Park CO, Lofftus SY, Mei S, Liu X, Luo C, O'Malley JT, Gehad A, Teague JE, Divito SJ, Fuhlbrigge R, Puigserver P, Krueger JG, Hotamisligil GS, Clark RA, Kupper TS. Survival of tissue-resident memory T cells requires exogenous lipid uptake and metabolism[J]. Nature, 2017, 543(7644): 252-256.
[DOI]
|
| [18] |
Wang J, Wu X, Simonavicius N, Tian H, Ling L. Medium-chain fatty acids as ligands for orphan G protein-coupled receptor GPR84[J]. J Biol Chem, 2006, 281(45): 34457-34464.
[DOI]
|
| [19] |
Lattin JE, Schroder K, Su AI, Walker JR, Zhang J, Wiltshire T, Saijo K, Glass CK, Hume DA, Kellie S, Sweet MJ. Expression analysis of G protein-coupled receptors in mouse macrophages[J]. Immunome Res, 2008, 4: 5.
[DOI]
|
| [20] |
Yousefi S, Cooper PR, Potter SL, Mueck B, Jarai G. Cloning and expression analysis of a novel G-protein-coupled receptor selectively expressed on granulocytes[J]. J Leukoc Biol, 2001, 69(6): 1045-1052.
[DOI]
|
| [21] |
Recio C, Lucy D, Purvis GSD, Iveson P, Zeboudj L, Iqbal AJ, Lin D, O'Callaghan C, Davison L, Griesbach E, Russell AJ, Wynne GM, Dib L, Monaco C, Greaves DR. Activation of the immune-metabolic receptor GPR84 enhances inflammation and phagocytosis in macrophages[J]. Front Immunol, 2018, 9: 1419.
[DOI]
|
| [22] |
Nicol LS, Dawes JM, La Russa F, Didangelos A, Clark AK, Gentry C, Grist J, Davies JB, Malcangio M, McMahon SB. The role of G-protein receptor 84 in experimental neuropathic pain[J]. J Neurosci, 2015, 35(23): 8959-8969.
[DOI]
|
| [23] |
Rajaram MV, Ni B, Dodd CE, Schlesinger LS. Macrophage immunoregulatory pathways in tuberculosis[J]. Semin Immunol, 2014, 26(6): 471-485.
[DOI]
|
| [24] |
Huang L, Nazarova EV, Tan S, Liu Y, Russell DG. Growth of Mycobacterium tuberculosis in vivo segregates with host macrophage metabolism and ontogeny[J]. J Exp Med, 2018, 1135-1152.
[URI]
|
| [25] |
Huang L, Nazarova EV, Russell DG. Mycobacterium tuberculosis: bacterial fitness within the host macrophage[J]. Microbiol Spectr, 2019, 7(2): 10.1128/microbiolspec.BAI-0001-2019.
[DOI]
|
| [26] |
Pisu D, Huang L, Narang V, Theriault M, Lê-Bury G, Lee B, Lakudzala AE, Mzinza DT, Mhango DV, Mitini-Nkhoma SC, Jambo KC, Singhal A, Mwandumba HC, Russell DG. Single cell analysis of M. tuberculosis phenotype and macrophage lineages in the infected lung[J]. J Exp Med, 2021, 218(9): e20210615.
[DOI]
|
| [27] |
Leemans JC, Juffermans NP, Florquin S, van Rooijen N, Vervoordeldonk MJ, Verbon A, van Deventer SJ, van der Poll T. Depletion of alveolar macrophages exerts protective effects in pulmonary tuberculosis in mice[J]. J Immunol, 2001, 166(7): 4604-4611.
[DOI]
|
| [28] |
Cohen SB, Gern BH, Delahaye JL, Adams KN, Plumlee CR, Winkler JK, Sherman DR, Gerner MY, Urdahl KB. Alveolar macrophages provide an early Mycobacterium tuberculosis niche and initiate dissemination[J]. Cell Host Microbe, 2018, 24(3): 439-446. e434.
[DOI]
|
| [29] |
Norris BA, Ernst JD. Mononuclear cell dynamics in M. tuberculosis infection provide opportunities for therapeutic intervention[J]. PLoS Pathog, 2018, 14(10): e1007154.
[DOI]
|
| [30] |
Eum SY, Kong JH, Hong MS, Lee YJ, Kim JH, Hwang SH, Cho SN, Via LE, Barry CE 3rd. Neutrophils are the predominant infected phagocytic cells in the airways of patients with active pulmonary TB[J]. Chest, 2010, 137(1): 122-128.
[DOI]
|
| [31] |
Sunderkötter C, Nikolic T, Dillon MJ, Van Rooijen N, Stehling M, Drevets DA, Leenen PJ. Subpopulations of mouse blood monocytes differ in maturation stage and inflammatory response[J]. J Immunol, 2004, 172(7): 4410-4417.
[DOI]
|
| [32] |
Nandi B, Behar SM. Regulation of neutrophils by interferon-γ limits lung inflammation during tuberculosis infection[J]. J Exp Med, 2011, 208(11): 2251-2262.
[DOI]
|
| [33] |
Desvignes L, Ernst JD. Interferon-gamma-responsive nonhematopoietic cells regulate the immune response to Mycobacterium tuberculosis[J]. Immunity, 2009, 31(6): 974-985.
[DOI]
|
| [34] |
Rhoades ER, Frank AA, Orme IM. Progression of chronic pulmonary tuberculosis in mice aerogenically infected with virulent Mycobacterium tuberculosis[J]. Tuber Lung Dis, 1997, 78(1): 57-66.
[DOI]
|
| [35] |
Hingley-Wilson SM, Sambandamurthy VK, Jacobs WR Jr. Survival perspectives from the world's most successful pathogen, Mycobacterium tuberculosis[J]. Nat Immunol, 2003, 4(10): 949-955.
[DOI]
|
| [36] |
Flynn JL. Lessons from experimental Mycobacterium tuberculosis infections[J]. Microbes Infect, 2006, 8(4): 1179-1188.
[DOI]
|
| [37] |
Schreiber HA, Harding JS, Hunt O, Altamirano CJ, Hulseberg PD, Stewart D, Fabry Z, Sandor M. Inflammatory dendritic cells migrate in and out of transplanted chronic mycobacterial granulomas in mice[J]. J Clin Invest, 2011, 121(10): 3902-3913.
[DOI]
|
| [38] |
Egen JG, Rothfuchs AG, Feng CG, Horwitz MA, Sher A, Germain RN. Intravital imaging reveals limited antigen presentation and T cell effector function in mycobacterial granulomas[J]. Immunity, 2011, 34(5): 807-819.
[DOI]
|
| [39] |
Egen JG, Rothfuchs AG, Feng CG, Winter N, Sher A, Germain RN. Macrophage and T cell dynamics during the development and disintegration of mycobacterial granulomas[J]. Immunity, 2008, 28(2): 271-284.
[DOI]
|
| [40] |
Alaridah N, Lutay N, Tenland E, Rönnholm A, Hallgren O, Puthia M, Westergren-Thorsson G, Godaly G. Mycobacteria manipulate G-protein-coupled receptors to increase mucosal rac1 expression in the lungs[J]. J Innate Immun, 2017, 9(3): 318-329.
[DOI]
|
 2024, Vol. 19
2024, Vol. 19


