2. 微孢子虫感染与防控重庆市重点实验室,西南大学,重庆 400715;
3. 重庆市公共卫生医疗救治中心,重庆 400036
2. Chongqing Key Laboratory of Microsporidia Infection and Control, Southwest University, Chongqing 400715;
3. Chongqing public health medical center, Chongqing 400036, China
微孢子虫病(microsporidiosis)由微孢子虫(microsporidia)感染所引起,其易感人群主要是艾滋病患者、器官移植者、癌症患者、老人及儿童等免疫力低下的人群[1, 2]。1959年报道了第1例人类微孢子虫病; 1985年在艾滋病患者中发现毕氏肠微孢子虫[3, 4]。事实上,造成微孢子虫病的病原——微孢子虫是一大类专性细胞内寄生的真菌类病原,隶属于真菌界(Fungi),微孢子虫门(Microspora),微孢子虫纲(Microsporea),微孢子虫目(Microsporida)[5]。微孢子虫感染的宿主范围非常广泛,包括昆虫、鱼类、家畜以及人类[6, 7]。微孢子虫病的主要症状包括持续性腹泻、发热、食欲缺乏和体重减轻等,严重者还会出现肌炎、肝炎,乃至器官衰竭等,是免疫缺陷人群(如艾滋病患者与器官移植患者)的重要致死因素之一[8, 9]。因此,微孢子虫的检测和预防具有重要的公共卫生意义。若能大范围开展微孢子虫感染的快速检测,做到早发现、早治疗,将有效控制微孢子虫病的传播,并提高患者的生活质量和生存率。
目前最受关注的能感染人的微孢子虫主要有毕氏肠微孢子虫(E. bieneusi)、海伦脑炎微孢子虫(E. hellem)、肠脑炎微孢子虫(E. intestinalis)以及兔脑炎微孢子虫(E. cuniculi)[10]。关于人类免疫缺陷病毒(human immunodeficiency virus, HIV)携带者感染毕氏肠微孢子虫已有众多报道,截至2018年已有47个流行病学调查,涉及超18 000名HIV携带者,涵盖23个国家和地区,其结果显示在HIV携带者中毕氏肠微孢子虫的感染率约为12%[11]。目前我国HIV感染者中微孢子虫感染情况的调查仍集中在上海、广西、河南等中、东部地区,缺乏对重庆市乃至西南地区的情况调查[12]。随着本地区的经济逐步发展、流动人口增加,急需对HIV携带者的微孢子虫共感染情况进行调查和数据统计,以期为公共卫生预防和精准治疗提供有力支持。
本研究采集了重庆市公共卫生医疗救治中心收治的22名HIV携带者的粪便样品,对微孢子虫感染情况进行了首次调查统计,期望为阐明微孢子虫与宿主相互作用关系以及微孢子虫防控提供数据支持。
1 材料和方法 1.1 研究对象本研究选取的病例来自于重庆市公共卫生医疗救治中心根据2018版《中国艾滋病诊疗指南》艾滋病诊断标准[13]确诊的HIV感染患者共22例。所有患者经免疫印迹法确认为HIV抗体阳性,HIV核酸检测阳性,并且这些患者均有不明原因的持续或反复腹泻症状。
1.2 方法 1.2.1 粪便样本收集和总DNA提取收集22例患者的粪便,对样本进行随机编号标记并存于-20 ℃待用。使用QIAGEN QIAamp© DNA Stool粪便提取试剂盒(Cat. No.51504, QIAGEN, Germany),按生产商提供的说明书,分别提取上述患者的粪便总DNA,标记并存于-20 ℃待用。
1.2.2 聚合酶链反应(polymerase chain reaction,PCR)检测引物与条件采用PCR法分别扩增微孢子虫的SSU rRNA序列片段,检测兔脑炎微孢子虫、海伦脑炎微孢子虫、肠脑炎微孢子虫、毕氏肠微孢子虫。扩增引物参照Al-Herrawy等[14]进行设计合成,引物序列如表 1所示。PCR扩增体系为25 μL,扩增条件为95 ℃预变性4 min; 94 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,进行35个循环,72 ℃延伸10 min。以1%琼脂糖凝胶电泳检测PCR产物。
将PCR产物用1%琼脂糖凝胶电泳和胶回收试剂盒分别进行纯化和回收,然后用pMD19-T载体将回收的片段进行连接。将连接体系混合后,于16 ℃金属浴过夜。将连接产物转化到大肠埃希菌感受态细胞DH5α中,将转化后的大肠埃希菌DH5α用含相应抗生素的LB固体培养基进行筛选,将筛选出的阳性菌落接种于含氨苄西林(100 μg/mL)的LB液体培养基,置于摇床中37 ℃培养约6 h。取1 mL培养的菌液,用T载体通用引物M13(F: TGTAAAAC-GACGGCCAGT; R: CAGGAAACAGCTATGA-CC)进行PCR检测。确认连接后,将阳性菌液送上海生工进行测序。测序结果使用NCBI、MicrosporidiaDB以及ClustalO等软件进行序列对比分析。
1.2.4 免疫细胞分析分别对22例患者采集外周静脉血,当天对CD4+ T细胞、CD8+ T细胞的亚群进行计数和分析,所用仪器为美国BD FACSCalibur流式细胞仪; 各亚群正常值范围参照国家卫生健康委员会《艾滋病和艾滋病病毒感染诊断》标准(标准号WS 293-2008)、中华医学会《艾滋病诊疗指南》等文献[13, 15-17]。
1.3 统计学方法采用SPSS16.0统计软件处理,计量资料以均值±标准差(x±s)表示。组间比较采用t检验,以P < 0.05为差异有统计学意义。
2 结果 2.1 HIV携带者微孢子虫感染情况对22份HIV携带者粪便DNA样本进行PCR扩增。琼脂糖凝胶电泳结果显示微孢子虫阳性的样本有9份,样品编号为9,10,11,12,13,17,19,21,22(图 1)。为进一步确认微孢子虫感染情况,将9份阳性标本的电泳条带分别进行胶回收、测序,结果提示9份阳性样品中有8份样品(编号9,10,12,13,17,19,21,22)被确认为人微孢子虫脑炎微孢子虫属(海伦脑炎微孢子虫、肠脑炎微孢子虫)感染,感染率为36.3%(8/22);有1份样品(编号11)测序结果不是微孢子虫,判断为PCR结果假阳性(表 2)。
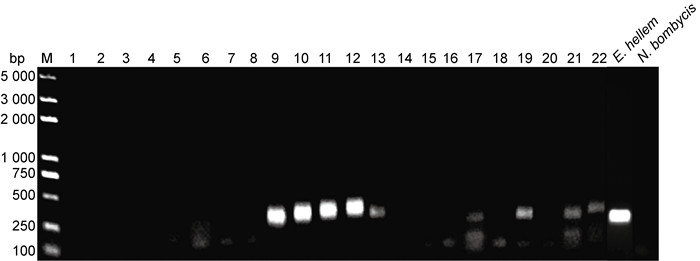
|
| 图 1 22份样品的核酸检测结果 Fig. 1 Nucleic acid electrophoresis to assess the PCR results of samples #1 to #22 (lane 1 to lane 22, respectively). Lane 9, 10, 11, 12, 13, 17, 19, 21 and 22 show positive bands at expected size range. The positive control uses the extracted genome of E. hellem as template, the amplified band is at the expected size range. The negative control uses the extracted genome of N. bombycis as template, no band was amplified. |
| Sample | PCR results | Sequences analysis |
| 1-8 | — | — |
| 9 | 250bp-279bp | E.hellem (99% identities) |
| 10 | 250bp-279bp | E.hellem (98% identities) |
| 11 | 250bp-279bp | No match of microsporidia |
| 12 | 250bp-279bp | E.intestinalis (89% identities) |
| 13 | 250bp-279bp | E.hellem (99% identities) |
| 14-16 | — | — |
| 17 | 250bp-279bp | E.hellem (99% identities) |
| 18 | — | — |
| 19 | 250bp-279bp | E.intestinalis (89% identities) |
| 20 | — | — |
| 21 | 250bp-279bp | E.hellem (99% identities) |
| 22 | 250bp-279bp | E.hellem (99% identities) |
将PCR检测阳性的9份样品进行DNA测序,利用ClustalO软件将测序结果与NCBI和MicrosporidiaDB数据库中微孢子虫标准序列进行比对分析。结果显示:除1份不是微孢子虫感染外,其余8份均为脑炎微孢子虫属(Encephalitozoon spp)的海伦脑炎微孢子虫或肠脑炎微孢子虫感染。图 2为本次检测部分样品序列分别与海伦脑炎微孢子虫(ATCC 50504)及肠脑炎微孢子虫(ATCC 50651)序列比对分析的结果。
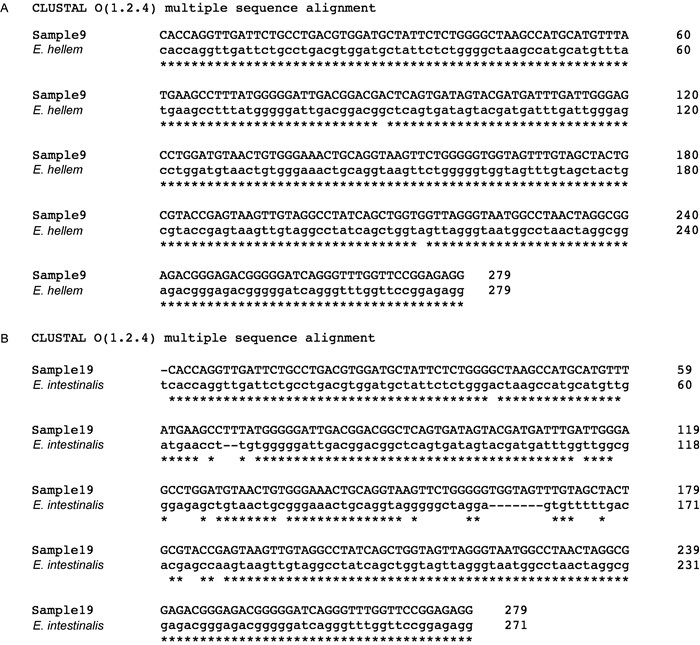
|
| 图 2 部分样品测序结果与标准株的比较 Fig. 2 Sequence analysis and comparison. A: Sequence comparison between sample 9 and E. hellem (ATCC 50504) SSUrRNA gene, the sequence identity is 99%. B: Sequence comparison between sample 19 and E. intestinalis (ATCC 50651) SSUrRNA gene, the sequence identity is 89%. |
对患者免疫细胞亚群进行计数分析,见表 3。结果显示,22例患者平均淋巴细胞总数0.93±0.13×109/L,CD4+ T细胞数132±22个/mL,CD8+ T细胞数495±91个/mL,CD4/CD8细胞比值0.37±0.1,远低于参考值。这提示22例患者免疫功能都受到严重抑制,是机会性病原感染的高危人群。进一步将微孢子虫感染患者与未感染患者的免疫细胞亚群进行比对,结果显示,感染患者淋巴细胞数为0.51±0.1×109/L,未感染患者1.17±0.17×109/L,两者具有显著差异(P < 0.05);感染患者的CD4+ T细胞数为71±27个/mL,未感染患者的为167±28个/mL,两者具有显著差异(P < 0.05);感染患者的CD8+ T细胞数为209±35个/mL,未感染患者的为658±123个/mL,两者具有显著差异(P < 0.05)。表明微孢子虫感染组的免疫功能受损情况更严重,进一步证实微孢子虫感染与患者的免疫状态密切相关。
| Lymphocyte subpopulation | All patients (22) | Microsporidia- infected patients (8) | Un-infected patients (14) | P value (between infected & un-infected) | Reference range |
| Total lymphocytes (109/L) | 0.93±0.13 | 0.51±0.1 | 1.17±0.17 | 0.012* | 1.1-3.2 |
| CD4+ T cell (cells/mL) | 132±22 | 71±27 | 167±28 | 0.034* | 414-1 123 |
| CD8+ T cell (cells/mL) | 495±91 | 209±35 | 658±123 | 0.014* | 238-874 |
| CD4+/CD8+ T cell (rate) | 0.37±0.1 | 0.51±0.26 | 0.29±0.05 | 0.289 | 0.9-3 |
| *:P < 0.05 | |||||
自1985年首次在艾滋病(acquired immune deficiency syndrome,AIDS)患者中检出微孢子虫后,国际上关于微孢子虫流行病学的调查越来越多[18]。但在我国,直到近年学界才对微孢子虫的流行情况逐渐重视[19]。将我国部分地区HIV携带者的微孢子虫感染情况进行总结发现,微孢子虫的平均感染率约为5.6%;在常见的4种感染人的微孢子虫中,毕氏肠微孢子虫仍是主要病原,最高平均感染率可达22.5%[11, 20]。关于重庆地区AIDS患者中微孢子虫的感染情况还未见任何报道,本研究对重庆地区HIV携带者中微孢子虫感染情况首次进行调查。在检测的22名HIV携带者中,有8名确认为微孢子虫感染,感染率为36.3%,这一比例在我国属高发。通过DNA序列比对发现,感染主要由脑炎微孢子虫属的海伦脑炎微孢子虫或肠脑炎微孢子虫引起。
当前普遍认为肠微孢子虫属的毕氏肠微孢子虫(E. bieneusi)是造成AIDS患者腹泻的主要病原[19],例如海伦脑炎微孢子虫虽然也引起腹泻,但更多的研究是关注其对眼、肺等部位的感染[21, 22],而本研究所检出的微孢子虫感染主要是由脑炎微孢子虫属引起。既往研究提示脑炎微孢子虫属的感染不如毕氏肠微孢子虫普遍,但是本研究的结果显示,重庆地区脑炎微孢子虫属的感染情况更为普遍,说明微孢子虫感染或许具有地域分布或者易感人群特异性; 抑或是由于重庆地区是肺结核及肺结核合并HIV感染的高发地区,这造成肺部感染的脑炎微孢子虫属更容易在患者体内定植。值得注意的是,本研究仅检测了22例患者,急需扩大检测范围,从而对该地区HIV感染者的微孢子虫感染情况获得更全面和准确的判断。
HIV感染会导致宿主免疫系统严重受损,特别是淋巴细胞数量因CD4+ T细胞数的降低而显著改变; 其中CD4+ T细胞的数值更是作为AIDS诊断和治疗效果评估的重要指标之一。当患者被HIV感染后,CD4+ T细胞可极速下降至200个/mL,甚至更低。患者出现AIDS症状,免疫功能低下,导致机体更容易被机会性病原感染[23]; 在患者进行抗病毒治疗(anti-retroviral therapy, ART)后,其CD4+ T细胞数随着病毒载量下降而有所上升,可至350个/mL或更高,患者免疫力也随之增强[24, 25]。本研究收集的22例AIDS患者恰好是刚检出HIV抗体阳性但还未开始ART的患者,其CD4+ T细胞的平均值只有132±22个/mL,因此是机会性病原感染的高危人群。本研究结果显示,这22例患者中有8例受到微孢子虫感染(感染率36.3%),相较于其他文献中所选取的正接受抗病毒治疗患者的微孢子虫感染率偏高,这也许是由于本研究的患者还未开始抗病毒治疗、免疫力极低所致。进一步对本研究中8例微孢子虫感染患者的免疫细胞亚群分析可以发现,其淋巴细胞总数、CD4+ T细胞、CD8+ T细胞等都较未感染微孢子虫患者的数值更低,证实微孢子虫机会性感染与患者的免疫状态密切相关。由此可知,对HIV携带者进行有效的抗病毒治疗,帮助他们恢复和重建免疫功能,对于降低机会性病原感染及提高患者预后和生活质量都有非常重要的意义。
作为机会性病原,微孢子虫主要感染免疫力低下人群,其中AIDS患者是主要易感人群。而随着我国HIV感染人数逐年增多,及时对这些人群中微孢子虫的感染情况进行监测和报道将是有效控制微孢子虫感染、提高AIDS患者生活质量甚至挽救其生命的重要基础。同时,许多文献指出HIV抗体阴性人群也会检测出微孢子虫感染,但其感染率非常低且基本不出现明显临床症状[18]。HIV抗体阴性人群被微孢子虫感染虽然不是因为病毒造成免疫力低下的结果,但极有可能是因为其他因素如结核分枝杆菌感染、胸腺发育不良等原因影响了机体免疫功能从而变得更加易感[2]。这不仅再次证明微孢子虫感染与宿主免疫状态密切相关,也揭示了微孢子虫感染范围广,其影响可能不局限于AIDS患者这一现象。因此,很有必要将微孢子虫检测纳入临床常规诊治,期待本研究结果及更多类似的报道可使临床和科研人员认识微孢子虫,以便对其进行准确检测,进而有效控制微孢子虫感染。
| [1] |
Franzen C, Müller A. Microsporidiosis: human diseases and diagnosis[J]. Microbes Infect, 2001, 3(5): 389-400.
[DOI]
|
| [2] |
Weber R, Bryan RT. Microsporidial infections in immunodeficient and immunocompetent patients[J]. Clin Infect Dis, 1994, 19(3): 517-521.
[URI]
|
| [3] |
Desportes I, Le Charpentier Y, Galian A, Bernard F, Cochand-Priollet B, Lavergne A, Ravisse P, Modigliani R. Occurrence of a new microsporidan: Enterocytozoon bieneusi n.g., n. sp., in the enterocytes of a human patient with AIDS[J]. J Protozool, 1985, 32(2): 250-254.
[DOI]
|
| [4] |
Matsubayashi H, Koike T, Mikata I, Takei H, Hagiwara S. A case of Encephalitozoon-like body infection in man[J]. AMA Arch Pathol, 1959, 67(2): 181-187.
[URI]
|
| [5] |
James TY, Kauff F, Schoch CL, Matheny PB, Hofstetter V, Cox CJ, Celio G, Gueidan C, Fraker E, Miadlikowska J, Lumbsch HT, Rauhut A, Reeb V, Arnold AE, Amtoft A, Stajich JE, Hosaka K, Sung GH, Johnson D, O'Rourke B, Crockett M, Binder M, Curtis JM, Slot JC, Wang Z, Wilson AW, Schüssler A, Longcore JE, O'Donnell K, Mozley-Standridge S, Porter D, Letcher PM, Powell MJ, Taylor JW, White MM, Griffith GW, Davies DR, Humber RA, Morton JB, Sugiyama J, Rossman AY, Rogers JD, Pfister DH, Hewitt D, Hansen K, Hambleton S, Shoemaker RA, Kohlmeyer J, Volkmann-Kohlmeyer B, Spotts RA, Serdani M, Crous PW, Hughes KW, Matsuura K, Langer E, Langer G, Untereiner WA, Lücking R, Büdel B, Geiser DM, Aptroot A, Diederich P, Schmitt I, Schultz M, Yahr R, Hibbett DS, Lutzoni F, McLaughlin DJ, Spatafora JW, Vilgalys R. Reconstructing the early evolution of Fungi using a six-gene phylogeny[J]. Nature, 2006, 443(7113): 818-822.
[DOI]
|
| [6] |
Mathis A, Weber R, Deplazes P. Zoonotic potential of the microsporidia[J]. Clin Microbiol Rev, 2005, 18(3): 423-445.
[DOI]
|
| [7] |
Pan G, Bao J, Ma Z, Song Y, Han B, Ran M, Li C, Zhou Z. Invertebrate host responses to microsporidia infections[J]. Dev Comp Immunol, 2018, 83: 104-113.
[DOI]
|
| [8] |
Meissner EG, Bennett JE, Qvarnstrom Y, da Silva A, Chu EY, Tsokos M, Gea-Banacloche J. Disseminated microsporidiosis in an immunosuppressed patient[J]. Emerging infectious diseases, 2012, 18(7): 1155-1158.
[DOI]
|
| [9] |
Sak B, Kotková M, Hlásková L, Kvá? M. Limited effect of adaptive immune response to control encephalitozoonosis[J]. Parasite Immunol, 2017, 39(12): e12496.
[DOI]
|
| [10] |
Didier ES, Weiss LM. Microsporidiosis: not just in AIDS patients[J]. Curr Opin Infect Dis, 2011, 24(5): 490-495.
[DOI]
|
| [11] |
Wang ZD, Liu Q, Liu HH, Li S, Zhang L, Zhao YK, Zhu XQ. Prevalence of Cryptosporidium, microsporidia and Isospora infection in HIV-infected people: a global systematic review and meta-analysis[J]. Parasit Vectors, 2018, 11(1): 28.
[URI]
|
| [12] |
Wang SS, Wang RJ, Fan XC, Liu TL, Zhang LX, Zhao GH. Prevalence and genotypes of Enterocytozoon bieneusi in China[J]. Acta Trop, 2018, 183: 142-152.
[DOI]
|
| [13] |
李太生, 王福生, 高福. 中国艾滋病诊疗指南(2018版)[J]. 中华内科杂志, 2018, 57(12): 867-884. [CNKI]
|
| [14] |
Al-Herrawy AZ, Gad MA. Microsporidial Spores in fecal samples of some domesticated animals living in Giza, Egypt[J]. Iran J Parasitol, 2016, 11(2): 195-203.
[URI]
|
| [15] |
Lavu EK, Kutson N, Connie C, Tau G, Sims P. Total lymphocyte counts in adult HIV/AIDS patients in Port Moresby General Hospital[J]. P N G Med J, 2004, 47(1-2): 31-38.
[URI]
|
| [16] |
Uppal SS, Verma S, Dhot PS. Normal values of CD4 and CD8 lymphocyte subsets in healthy indian adults and the effects of sex, age, ethnicity, and smoking[J]. Cytometry B Clin Cytom, 2003, 52(1): 32-36.
[URI]
|
| [17] |
沈芳, 陈戴红, 黄琴, 孙洪青, 陈沭, 高琼. 人类免疫缺陷病毒/丙型肝炎病毒混合感染者免疫细胞和肝生化指标的分析[J]. 微生物与感染, 2007, 2(1): 13-15. [URI]
|
| [18] |
Li W, Xiao L. Multilocus sequence typing and population genetic analysis of Enterocytozoon bieneusi: Host specificity and its impacts on public health[J]. Front Genet, 2019, 10: 307.
[DOI]
|
| [19] |
Qiu L, Xia W, Li W, Ping J, Ding S, Liu H. The prevalence of microsporidia in China: A systematic review and meta-analysis[J]. Sci Rep, 2019, 9(1): 3174.
[URI]
|
| [20] |
Zhang X, Wang Z, Su Y, Liang X, Sun X, Peng S, Lu H, Jiang N, Yin J, Xiang M, Chen Q. Identification and genotyping of Enterocytozoon bieneusi in China[J]. J Clin Microbiol, 2011, 49(5): 2006-2008.
[DOI]
|
| [21] |
Scaglia M, Sacchi L, Croppo GP, da Silva A, Gatti S, Corona S, Ornai A, Bernuzzi AM, Pieniazek NJ, Slemenda SB, Wallace S, Visvesvara GS. Pulmonary microsporidiosis due to Encephalitozoon hellem in a patient with AIDS[J]. J Infect, 1997, 34(2): 119-126.
[DOI]
|
| [22] |
Weber R, Kuster H, Visvesvara GS, Bryan RT, Schwartz DA, Lüthy R. Disseminated microsporidiosis due to Encephalitozoon hellem: pulmonary colonization, microhematuria, and mild conjunctivitis in a patient with AIDS[J]. Clin Infect Dis, 1993, 17(3): 415-419.
[URI]
|
| [23] |
Darraj M, Shafer LA, Chan S, Kasper K, Keynan Y. Rapid CD4 decline prior to antiretroviral therapy predicts subsequent failure to reconstitute despite HIV viral suppression[J]. J Infect Public Health, 2018, 11(2): 265-269.
[DOI]
|
| [24] |
Autran B, Carcelain G, Li TS, Blanc C, Mathez D, Tubiana R, Katlama C, Debré P, Leibowitch J. Positive effects of combined antiretroviral therapy on CD4+ T cell homeostasis and function in advanced HIV disease[J]. Science, 1997, 277(5322): 112-116.
[DOI]
|
| [25] |
Gueneau R, Dufresne S, Valran A, Janssen C, Leclercq P, Epaulard O. Immune profile at HIV infection diagnosis: Evolution in the French Alps area over the last 20 years[J]. Med Mal Infect, 2020, 50(5): 428-432.
[DOI]
|
 2020, Vol. 15
2020, Vol. 15


