2. 苏州大学附属儿童医院检验科,江苏 苏州 215025
2. Laboratory Department, Children's Hospital of Soochow University, Suzhou 215025, Jiangsu Province, China
宿主通过固有免疫应答和适应性免疫应答识别并清除病原体的过程称为抗感染免疫。固有免疫是机体与病原生物长期斗争过程中逐渐进化形成的免疫防御功能,主要由屏障结构、吞噬细胞以及正常体液和组织的多种抗菌物质等组成。病原体突破屏障结构侵入机体后,首先被吞噬细胞识别、吞噬和清除。其识别过程主要通过病原相关分子模式(pathogen-associated molecular patterns,PAMPs)与宿主模式识别受体(pattern recognition receptors,PRRs)的相互作用实现。病毒和细菌等微生物感染哺乳动物时,通过物理接触或菌体成分、代谢产物及分泌蛋白等生物或化学物质诱导宿主产生应答信号,引起宿主对感染的各种反应,这些物质被称为PAMPs[1]。PRRs是一类能够直接识别病原体、凋亡宿主细胞和受损衰老细胞表面特定分子结构的受体,存在于宿主细胞膜上、胞质内或胞核中。根据其蛋白质结构域的同源性,机体固有免疫的PRRs可分为5类:NOD样受体(nucleotide-binding oligomerization domain-like receptors,NLRs)、Toll样受体(Toll-like receptors,TLRs)、RIG-I样受体(retinoic acid-inducible gene-I-like receptors,RLRs)、C型凝集素受体(C-type lectin receptors,CLRs)和黑色素瘤缺乏因子2样受体(absent in melanoma-2-like receptors,ALRs)等[1-2]。含热蛋白结构域的核苷酸结合寡聚化结构样受体蛋白6(nucleotide-binding oligomerization domain-like receptor family pyrin domin containing 6, NLRP6)是NLRs家族中具有重要和特殊功能的成员之一,本文就其结构与功能及其在细菌感染时的作用特点和机制进行综述。
1 NLRP6的结构与功能NLRs由氨基端蛋白相互作用结构域、中间核苷酸结合寡聚化结构域(nucleotide-binding oligomerization domain,NBD)和羧基端富亮氨酸结构域(leucine-rich repeat domain,LRR)3个部分组成[3]。根据氨基端结构域不同将NLRs家族分为NLRA、NLRB、NLRP和NLRC 4个亚家族,NLRP是其中氨基端含热蛋白结构域(pyrin domain,PYD)的亚家族,包含14个不同的家族成员,也是迄今为止最大的NLRs亚家族[4-5]。NLRP6是NLRP亚家族成员之一,其编码基因位于人类11号染色体,早期亦被称为含热蛋白结构域的凋亡蛋白酶激活因子-1样蛋白5(pyrin-containing apoptosis protease activating factor(apaf)-1-like proteins 5,PYPAF5)[6]。
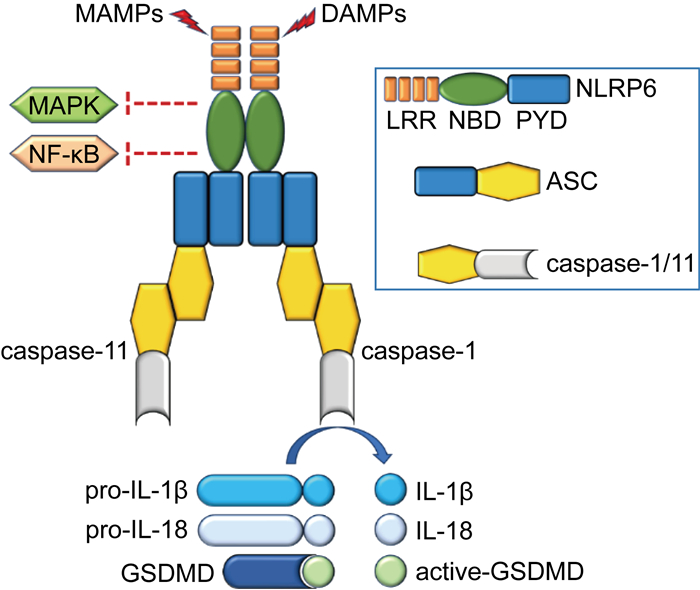
生理情况下NLRP6在肠道、肝、肺和肾等脏器以及巨噬细胞、中性粒细胞和上皮细胞中高表达,可以单体或复合体的形式发挥作用[7]。NLRP6可通过抑制丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)与核因子-κB(nuclear factor-kappaB,NF-κB)信号通路的激活,降低MAPK和NF-κB依赖的细胞因子和趋化因子的水平[8]。NLRP6还可识别微生物相关分子模式(microbe-associated molecular patterns,MAMPs)和损伤相关分子模式(damage-associated molecular patterns,DAMPs),招募凋亡相关斑点样蛋白(apoptosis-associated speck-like protein,ASC)受体和炎性半胱天冬蛋白酶1(caspase-1)或caspase-11,进而形成炎性小体复合物介导促炎细胞因子IL-18和IL-1 β的成熟与释放;亦可介导焦亡(pyroptosis)等炎性细胞死亡形式的发生[9](见图 1)。
NLRP6与多种人类疾病相关,参与机体感染、炎症、肿瘤和代谢性疾病的调节[6]。研究发现,宿主NLRP6在抗细菌感染时具有异质性,可起抑制或保护的作用[8, 10-12];它还参与MHC Ⅰ类分子抗原递呈的调节和抗病毒效应功能[13];感知肠道细胞内的寄生虫并招募ASC组装形成炎性小体,促进IL-18的释放[14]。此外,NLRP6可减轻外周和中枢神经炎症,促进神经损伤恢复;作为负性调控因子降低机体对结直肠肿瘤的易感性;通过调节肠道菌群减缓非酒精性脂肪肝和肥胖症的发展[15]。
2 NLRP6与细菌感染细菌感染与机体抗感染免疫之间的抗衡结果决定了感染的转归和结局。抗菌药物用于防治细菌感染,然而细菌耐药的迅速出现甚至多重和“超级”耐药菌的出现,对生命健康构成了极大威胁,是引起全球人类死亡的重要原因[16]。抗细菌感染面临着巨大的困难和挑战,探寻抗生素替代疗法迫在眉睫。宿主导向疗法(host-directed therapy,HDT)是一种新兴的抗感染治疗方法,从宿主角度干预相关信号通路的关键分子以达到减轻炎症反应和抗感染的效果[17-18]。结合NLRP6在抗感染免疫中的重要作用,通过干预宿主相关信号事件,对深入研究和发现NLRP6的功能并应用于细菌感染的防治具有重要意义。
2.1 革兰氏阳性菌金黄色葡萄球菌(Staphylococcus aureus)是临床最常见的革兰氏阳性胞外菌,不仅能引起人类多种组织器官的化脓性感染,重者还可侵入血流导致脓毒血症和全身播散甚至死亡[19]。2018年Ghimire等[10]学者通过建立金黄色葡萄球菌肺部感染小鼠模型和骨髓来源中性粒细胞感染模型,发现金黄色葡萄球菌及其重要毒力因子α溶血素可激活NLRP6炎性小体;Nlrp6基因敲除型(Nlrp6-/-)小鼠肺泡灌洗液和肝脏中细菌载量明显低于野生型(wild type,WT)小鼠;Nlrp6-/-小鼠中性粒细胞向感染部位的募集亦多于WT小鼠。NLRP6通过抑制NK细胞介导的IFN-γ分泌,从而阻碍ROS依赖的中性粒细胞对细菌的清除作用。此外,Nlrp6-/-小鼠焦亡相关分子caspase-1和消皮素蛋白(gasdermin,GSDM)D表达均减少;坏死性凋亡相关分子受体相互作用蛋白激酶1(receptor interacting serine/threonine kinase 1,RIP1)、RIP3和混合谱系激酶结构域蛋白(mixed lineage kinase domain like pseudokinase,MLKL)的磷酸化水平亦降低。综合上述研究表明,金黄色葡萄球菌感染时NLRP6抑制中性粒细胞向感染部位趋化和杀菌功能,促进免疫细胞焦亡和坏死性凋亡,有利于细菌感染[11]。
肺炎链球菌(Streptococcus pneumoniae)是一种革兰氏阳性胞外菌,机会致病,可引起严重的上呼吸道感染,导致社区获得性肺炎、脓毒症和脑膜炎等疾病[20]。2021年Xu等[21]学者建立滴鼻感染WT和Nlrp6-/-小鼠模型,发现Nlrp6-/-小鼠感染肺炎链球菌后肺部细菌载量低,炎症反应轻,死亡率低;提取的Nlrp6-/-小鼠腹腔渗出巨噬细胞与肺炎链球菌共培养后,产生的促炎细胞因子IL-1 β、IL-1 α和IL-6明显减少;还发现NLRP6通过调节IL-1 β的mRNA表达而非转录过程影响了IL-1 β的成熟与分泌。上述研究从体内和体外两方面表明,NLRP6在肺炎链球菌感染中起负向调控作用[21]。一年后,该团队进一步应用相同的感染模型探索了NLRP6在肺炎链球菌感染中起负向调控作用的机制,发现肺炎链球菌感染时NLRP6降低了CXCL1和CXCL2等趋化因子的表达,从而抑制中性粒细胞向肺部等感染部位的募集;与此同时,中性粒细胞胞外诱捕网(neutrophil extracellular traps,NETs)的生成减少,抑制了细胞对细菌的杀伤作用[22]。
产单核细胞李斯特菌(Listeria monocytogenes) 是一种机会致病性革兰氏阳性兼性胞内菌,主要感染新生儿、老年人、孕妇以及免疫功能低下者,可引起败血症、脑膜炎和胎盘感染等[23]。2012年Anand等[8]学者首次报道,产单核细胞李斯特菌感染小鼠骨髓来源巨噬细胞时,NLRP6特异性抑制TLRs诱导的NF-κB和MAPK信号通路的激活,减少相关细胞因子和趋化因子的产生,不利于宿主抗感染免疫应答。2018年,Hara等[24]学者将产单核细胞李斯特菌分别与WT和Nlrp6-/-小鼠巨噬细胞共培养发现,NLRP6招募ASC受体激活caspase-11,进而促进caspase-1依赖的IL-1 β和IL-18的释放;通过建立Nlrp6-/-、Pycard-/-和Caspase11-/-等巨噬细胞模型发现,革兰氏阳性菌LTA刺激巨噬细胞后亦经NLRP6-ASC-caspase-11途径,切割caspase-1前体促进IL-1 β的成熟与释放。上述研究结果表明,LTA可结合并激活NLRP6形成炎性小体复合物,促进IL-18的形成,从而加重革兰氏阳性菌感染。
2.2 革兰氏阴性菌肺炎克雷伯菌(Klebsiella pneumoniae)是一种革兰氏阴性胞外菌,广泛分布于自然界的水、土壤和动物体内,在医院环境和医疗器械中多有定植。该菌具有高致病率和高致死率,感染人类可引起重症肺炎、尿路感染和败血症等[25]。2021年Cai等[11]学者分别经WT和Nlrp6-/-小鼠气管滴注肺炎克雷伯菌建立感染模型,发现Nlrp6-/-小鼠中性粒细胞向肺部趋化减少,肺部和脾脏细菌载量增加,死亡率增加;尽管实验发现Nlrp6-/-小鼠肠道菌群中普雷沃菌科(Prevotellaceae)和帕拉普菌科(Paraprevotellaceae)增多,但与WT小鼠同笼共养后对肺炎克雷伯菌的易感性差异仍然存在,未发现该差异与肠道菌群的变化相关。应用小鼠骨髓来源中性粒细胞体外感染模型发现,Nlrp6-/-小鼠NETs生成和杀菌作用减弱;补充中性粒细胞趋化因子CXCL1可减轻上述改变,说明NLRP6通过增加趋化因子CXCL1的产生促进了宿主抵抗肺炎克雷伯菌感染[12]。
鼠伤寒沙门菌(Salmonella typhimurium)是一种在自然界中广泛分布的革兰氏阴性兼性胞内菌,也是研究细菌感染与机体免疫的典型模式菌[26-27]。Anand等[8]应用鼠伤寒沙门菌感染巨噬细胞模型发现,NLRP6可增强Toll样受体诱导的巨噬细胞MAPK通路与NF-κB通路的激活,说明NLRP6促进了鼠伤寒沙门菌感染。本课题组构建了WT和Nlrp6-/-人结肠癌上皮细胞Caco-2模型和小鼠口饲感染模型,发现NLRP6抑制蛋白激酶B信号途径破坏了肠上皮顶端连接复合体的完整性,进而增强宿主对沙门菌感染的易感性;沙门菌感染时宿主NLRP6调控转化生长因子活化激酶1(transforming growth factor beta activated kinase 1,TAK1)/P38/MAPK活化蛋白激酶2(MAPK-activated protein kinase 2,MK2)信号通路,抑制了RIP1在S321位点的磷酸化,从而上调RIP1在S166位点的磷酸化水平,促进肠上皮细胞坏死性凋亡[28]。NLRP6调节宿主铁代谢扰乱对沙门菌感染的防御作用,敲除小鼠Nlrp6有利于维持巨噬细胞和上皮细胞铁稳态;NLRP6与蛋白激酶B结合抑制其磷酸化,进而经核因子E2相关因子2(nuclear factor erythroid-derived 2-related factor 2,NRF2)/膜铁转运蛋白(ferroportin,FPN)途径导致宿主铁代谢紊乱,促进了沙门菌繁殖和致病[29]。生物钟核心蛋白核血红素受体α (reverse erythroblastosis virus α,REV-ERB α)通过抑制肠上皮细胞NLRP6的转录及其蛋白表达调控肠道炎症反应,从而限制沙门菌播散减轻感染。以上研究表明,沙门菌感染时NLRP6不利于宿主抗感染,调控NLRP6的表达可为防治沙门菌感染提供新思路。
大肠埃希菌(Escherichia coli)是革兰氏阴性胞外菌。某些血清型的大肠埃希菌,如肠产毒素性、肠侵袭性、肠致病性、肠出血性和肠聚集性大肠埃希菌等可致肠道感染,引起严重腹泻、剧烈腹痛、呕吐等消化道症状,重者甚至引起死亡。作为肠道中重要的正常菌群之一,其在机体免疫力低下或移位至肠道外时可成为机会致病菌,导致败血症和泌尿道感染等。早在2012年,Anand等[8]在《Nature》报道,应用产单核细胞李斯特菌、鼠伤寒沙门菌和大肠埃希菌探究不同革兰氏染色性质和细胞内外寄居特点的细菌感染时宿主NLRP6的作用。他们的研究发现,大肠埃希菌、产单核细胞李斯特菌和鼠伤寒沙门菌感染时Nlrp6-/-小鼠肝脏和脾脏的细菌载量比WT小鼠明显减少,表明NLRP6促进了细菌在体内的播散[8]。多杀巴氏菌(Pasteurella multocida)是一种动物源性革兰氏阴性菌,可引起家禽和野生动物的广泛感染,导致败血症和禽霍乱等疾病,其高致病率和死亡率严重影响了畜牧业的经济发展。研究表明多杀巴氏菌感染时,Nlrp6-/-小鼠肺部细菌载量高于WT小鼠,巨噬细胞和中性粒细胞向肺部募集以及NETs的生成减少,表明NLRP6可降低机体对多杀巴氏菌的易感性,有利于机体抗感染[30]。
综上所述,NLRP6在机体固有免疫中的作用具有双重性(见表 1),一些研究表明NLRP6可增强宿主对某些细菌的易感性,不利于机体抗感染;而另一些研究则显示,NLRP6可保护宿主增强机体的抵抗力。NLRP6在宿主抗感染免疫中的关键调控机制仍不甚清晰,亦是目前该研究领域面临的问题和挑战。首先,尽管沙门菌和肺炎克雷伯菌等革兰氏阴性菌可激活NLRP6,其菌体成分LPS未被发现激活NLRP6形成炎性小体,革兰氏阴性菌激活NLRP6的具体机制尚不明确[8, 11],应用冷冻电镜技术从原子结构水平分析NLRP6与配体的结合方式或许是研究的突破点。其次,感染的转归亦与炎性小体激活后的下游效应相关,除分泌促炎细胞因子外,细胞焦亡的诱导、肠道屏障功能、适应性免疫和细胞代谢的调节亦是需要进一步研究的方向。此外,目前已有几种NLRP3炎性小体激活抑制剂(如MCC950和CY-09)被认可,并作为有希望的干预措施应用于不同的疾病模型。而对于NLRP6在人类健康和疾病中的作用还知之甚少,对NLRP6炎性小体的干预有望成为潜在治疗靶点,改善包括细菌感染在内的疾病转归[9, 31]。
| 细菌 | 革兰氏染色 | 寄居特点 | 感染部位/细胞 | NLRP6在抗感染免疫中的作用 | 作用机制 |
| 金黄色葡萄球菌 | G+ | 胞外 | 肺部 | 不利于抗感染 | 抑制中性粒细胞;促进焦亡和坏死性凋亡 |
| 肺炎链球菌 | G+ | 胞外 | 肺部 | 不利于抗感染 | 减少趋化因子表达;抑制中性粒细胞及NETs |
| 产单核细胞李斯特菌 | G+ | 兼性胞内 | 巨噬细胞 | 不利于抗感染 | 抑制NF-κB和MAPK信号通路;促进IL-18形成 |
| 肺炎克雷伯菌 | G- | 胞外 | 肺部/中性粒细胞 | 有利于抗感染 | 促进CXCL1产生 |
| 鼠伤寒沙门菌 | G- | 兼性胞内 | 肠道/Caco-2细胞等 | 不利于抗感染 | 破坏肠屏障;促进肠上皮坏死性凋亡;扰乱铁稳态 |
| 大肠埃希菌 | G- | 胞外 | 腹腔 | 不利于抗感染 | 抑制NF-κB和MAPK信号通路 |
| 多杀巴氏菌 | G- | 胞外 | 肺部 | 有利于抗感染 | 促进中性粒细胞趋化及NETs |
尽管抗生素的应用降低了细菌感染造成的死亡率,但个体免疫缺陷、婴幼儿和老年病人数量增加,特别是多重耐药菌株的出现,大大降低了抗菌药物的疗效。细菌耐药性的增强给临床治疗感染性疾病带来了极大困难,从宿主免疫角度寻求抗感染的新策略具有重要意义。宿主NLRP6在抗细菌感染免疫中的作用具有异质性,一方面受细菌种属和血清型的影响,另一方面与感染途径、感染部位和感染时相有关,但其关键调控机制尚未完全明确。深入研究NLRP6在抗细菌感染免疫方面的作用和分子机制对探索防治细菌感染的新策略和思路具有重要意义。
| [1] |
Janeway CA Jr. Approaching the asymptote? Evolution and revolution in immunology[J]. Cold Spring Harb Symp Quant Biol, 1989, 54 Pt 1: 1-13.
[DOI]
|
| [2] |
Li D, Wu M. Pattern recognition receptors in health and diseases[J]. Signal Transduct Target Ther, 2021, 6(1): 291.
[DOI]
|
| [3] |
Alvarez CA, Ramirez-Cepeda F, Santana P, Torres E, Cortes J, Guzman F, Schmitt P, Mercado L. Insights into the diversity of NOD-like receptors: identification and expression analysis of NLRC3, NLRC5 and NLRX1 in rainbow trout[J]. Mol Immunol, 2017, 87: 102-113.
[DOI]
|
| [4] |
Meunier E, Broz P. Evolutionary convergence and divergence in NLR function and structure[J]. Trends Immunol, 2017, 38(10): 744-757.
[DOI]
|
| [5] |
Platnich JM, Muruve DA. NOD-like receptors and inflammasomes: a review of their canonical and non-canonical signaling pathways[J]. Arch Biochem Biophys, 2019, 670: 4-14.
[DOI]
|
| [6] |
Li R, Zhu S. NLRP6 inflammasome[J]. Mol Aspects Med, 2020, 76: 100859.
[DOI]
|
| [7] |
Venuprasad K, Theiss AL. NLRP6 in host defense and intestinal inflammation[J]. Cell Reports, 2021, 35(4): 109043.
[DOI]
|
| [8] |
Anand PK, Malireddi RK, Lukens JR, Vogel P, Bertin J, Lamkanfi M, Kanneganti TD. NLRP6 negatively regulates innate immunity and host defence against bacterial pathogens[J]. Nature, 2012, 488(7411): 389-393.
[DOI]
|
| [9] |
Zheng D, Kern L, Elinav E. The NLRP6 inflammasome[J]. Immunology, 2021, 162(3): 281-289.
[DOI]
|
| [10] |
Ghimire L, Paudel S, Jin L, Baral P, Cai S, Jeyaseelan S. NLRP6 negatively regulates pulmonary host defense in Gram-positive bacterial infection through modulating neutrophil recruitment and function[J]. PLoS Pathog, 2018, 14(9): e1007308.
[DOI]
|
| [11] |
Cai S, Paudel S, Jin L, Ghimire L, Taylor CM, Wakamatsu N, Bhattarai D, Jeyaseelan S. NLRP6 modulates neutrophil homeostasis in bacterial pneumonia-derived sepsis[J]. Mucosal Immunol, 2021, 14(3): 574-584.
[DOI]
|
| [12] |
Wlodarska M, Thaiss CA, Nowarski R, Henao-Mejia J, Zhang JP, Brown EM, Frankel G, Levy M, Katz MN, Philbrick WM, Elinav E, Finlay BB, Flavell RA. NLRP6 inflammasome orchestrates the colonic host-microbial interface by regulating goblet cell mucus secretion[J]. Cell, 2014, 156(5): 1045-1059.
[DOI]
|
| [13] |
Levy M, Shapiro H, Thaiss C A, Elinav E. NLRP6: a multifaceted innate immune sensor[J]. Trends Immunol, 2017, 38(4): 248-260.
[DOI]
|
| [14] |
Sateriale A, Gullicksrud JA, Engiles JB, McLeod BI, Kugler EM, Henao-Mejia J, Zhou T, Ring AM, Brodsky IE, Hunter CA, Striepen B. The intestinal parasite Cryptosporidium is controlled by an enterocyte intrinsic inflammasome that depends on NLRP6[J]. Proc Natl Acad Sci U S A, 2021, 118(2): e2007807118.
[DOI]
|
| [15] |
Ghimire L, Paudel S, Jin L, Jeyaseelan S. The NLRP6 inflammasome in health and disease[J]. Mucosal Immunol, 2020, 13(3): 388-398.
[DOI]
|
| [16] |
Antimicrobial Resistance Collaborators. Global burden of bacterial antimicrobial resistance in 2019: a systematic analysis[J]. Lancet, 2022, 399(10325): 629-655.
[DOI]
|
| [17] |
Chiang CY, Uzoma I, Moore RT, Gilbert M, Duplantier AJ, Panchal RG. Mitigating the impact of antibacterial drug resistance through host-directed therapies: current progress, outlook, and challenges[J]. mBio, 2018, 9(1): e01932-17.
[DOI]
|
| [18] |
Wallis RS, O'Garra A, Sher A, Wack A. Host-directed immunotherapy of viral and bacterial infections: past, present and future[J]. Nat Rev Immunol, 2023, 23(2): 121-133.
[DOI]
|
| [19] |
Tong SY, Davis JS, Eichenberger E, Holland TL, Fowler VG Jr. Staphylococcus aureus infections: epidemiology, pathophysiology, clinical manifestations, and management[J]. Clin Microbiol Rev, 2015, 28(3): 603-661.
[DOI]
|
| [20] |
Weiser JN, Ferreira DM, Paton JC. Streptococcus pneumoniae: transmission, colonization and invasion[J]. Nat Rev Microbiol, 2018, 16(6): 355-367.
[DOI]
|
| [21] |
Xu D, Wu X, Peng L, Chen T, Huang Q, Wang Y, Ye C, Peng Y, Hu D, Fang R. The critical role of NLRP6 inflammasome in Streptococcus pneumoniae infection in vitro and in vivo[J]. Int J Mol Sci, 2021, 22(8): 3876.
[DOI]
|
| [22] |
Tao Q, Xu D, Jia K, Cao X, Ye C, Xie S, Hu DL, Peng L, Fang R. NLRP6 serves as a negative regulator of neutrophil recruitment and function during Streptococcus pneumoniae infection[J]. Front Microbiol, 2022, 13: 898559.
[DOI]
|
| [23] |
Disson O, Moura A, Lecuit M. Making sense of the biodiversity and virulence of Listeria monocytogenes[J]. Trends Microbiol, 2021, 29(9): 811-822.
[DOI]
|
| [24] |
Hara H, Seregin SS, Yang D, Fukase K, Chamaillard M, Alnemri ES, Inohara N, Chen GY, Nunez G. The NLRP6 inflammasome recognizes lipoteichoic acid and regulates Gram-positive pathogen infection[J]. Cell, 2018, 175(6): 1651-1664.
[DOI]
|
| [25] |
Bengoechea JA, Sa Pessoa J. Klebsiella pneumoniae infection biology: living to counteract host defences[J]. FEMS Microbiol Rev, 2019, 43(2): 123-144.
[DOI]
|
| [26] |
Hausmann A, Hardt WD. The interplay between Salmonella enterica serovar Typhimurium and the intestinal mucosa during oral infection[J]. Microbiol Spectr, 2019, 7(2).
[DOI]
|
| [27] |
Herrero-Fresno A, Olsen JE. Salmonella Typhimurium metabolism affects virulence in the host-a mini-review[J]. Food Microbiol, 2018, 71: 98-110.
[DOI]
|
| [28] |
朱渊. NLRP6在沙门菌感染所致肠上皮细胞坏死性凋亡中的作用及其分子机制[D]. 江苏: 苏州大学, 2022.
|
| [29] |
Deng Q, Yang S, Sun L, Huang K, Dong K, Zhu Y, Cao Y, Li Y, Wu S, Huang R. A detrimental role of NLRP6 in host iron metabolism during Salmonella infection[J]. Redox Biol, 2022, 49: 102217.
[DOI]
|
| [30] |
Wu X, Zeng Z, Tian H, Peng L, Xu D, Wang Y, Ye C, Peng Y, Fang R. The important role of NLRP6 inflammasome in Pasteurella multocida infection[J]. Vet Res, 2022, 53(1): 81.
[DOI]
|
| [31] |
Zheng D, Liwinski T, Elinav E. Inflammasome activation and regulation: toward a better understanding of complex mechanisms[J]. Cell Discov, 2020, 6: 36.
[PubMed]
|
 2023, Vol. 18
2023, Vol. 18