2. 西安交通大学第一附属医院妇产科,陕西 西安 710061;
3. 西安正浩生物制药有限公司,陕西 西安 710119
2. Obstetrics and Gynecology Department of the First Affiliated Hospital of Xi'an Jiaotong University, Xi'an 710061, Shaanxi Province, China;
3. Xi'an Zhenghao Biological Pharmaceutical Co. LTD, Xi'an 710119, Shaanxi Province, China
外阴阴道假丝酵母菌病(vulvovaginal candidiasis,VVC)是一种常见的女性生殖道疾病,其主要病原菌包括光滑假丝酵母菌(Candida glabrata)、热带假丝酵母菌(Candida tropicalis)、白假丝酵母菌(Candida albicans)。VVC发病机制复杂,主要与两方面因素密切相关,一方面是病原菌的致病因素,包括病原菌的数量、分化状态、胞外酶的分泌、黏附因子和毒力因子等;另一方面是人体阴道微环境,包括局部免疫、激素分泌与调节、阴道菌群组成结构等。VVC的临床治疗方案首选局部或全身抗真菌药物治疗:对于由白假丝、热带假丝酵母菌诱发的侵袭性假丝酵母菌感染,主要使用氟康唑、克霉唑治疗[1];对于光滑假丝酵母菌感染,则首选制霉菌素、环吡司胺治疗[2]。抗真菌药物治疗的原则是消除诱因,其作用机制包括抑制病原菌细胞膜的合成、干扰病原菌代谢等,从而有效抑制病原菌的生长。然而,一旦停止巩固治疗,30%~50%的VVC患者会出现复发。此外,抗真菌药物也会诱导同源菌株发生耐药性改变,导致患者首次用药效果显著,但停药后复发概率较高[3]。
女性生殖道为开放性腔道,是人体内微生物群落定植的重要微生态区之一。在人体健康的状态下,阴道内形成以乳杆菌等优势菌为主要组成的微生态系统,这些优势菌群在生长的过程中通过分泌有机酸、细菌素、细胞因子等多种代谢产物来调节阴道微环境与局部免疫,微生物群落各成员之间相互影响、相互制约,从而形成动态平衡。在受到内、外源性因素的影响时,群落组成的变化会引发阴道微生态微环境的改变,这与感染和疾病的发生发展息息相关。因此,阴道菌群作为阴道微生态的重要组成部分,在妇女阴道感染性疾病的发生发展中发挥着重要的作用。既往研究发现,VVC患者阴道分泌物菌丝生长旺盛,真菌感染症状明显,阴道微生态失衡[4]。还有研究发现,VVC感染期阴道内乳杆菌丰度显著下降,抗真菌治疗的同时补充阴道益生菌能显著减轻症状[5]。VVC感染期患者是否存在真菌和细菌双重感染则未见报道,对于VVC患者的阴道菌群组成在治疗前后的差异及其与复发的相关性研究仍未有定论。本研究通过高通量测序技术分析健康女性和VVC患者的阴道分泌物中菌群结构在治疗前后的差异,有望为VVC发病机制研究及临床治疗提供有价值的依据。
1 材料和方法 1.1 研究对象选取2020年1月—2021年12月在西安交通大学第一附属医院妇产科就诊的VVC阴道炎患者18例,并同时招募无阴道炎患者27例,年龄分别是35.3±6.5岁和32.6±6.2岁,两组患者年龄、性别、病程、病因等因素的差异均无统计学意义(P>0.05)。
1.2 病例入选、排除标准VVC组纳入标准为以下3项条件须同时满足:①均为已婚女性,年龄20~49岁;②有VVC临床症状;③实验室检查:根据阴道微生态评价的临床应用专家共识[6]判定。阴道分泌物临床检查确诊VVC。NC组纳入标准为以下3项条件须同时满足:①为已婚女性,年龄20~49岁;②无VVC,排除其他阴道炎,月经正常;③阴道分泌物检查结果正常,清洁度Ⅰ~Ⅱ、pH值=3.8~4.5,分泌物以乳杆菌为主,镜检未找到菌丝。排除标准:妊娠期、哺乳期妇女,患有其他阴道炎如滴虫性、细菌性阴道病等,1个月内有抗生素使用史、免疫抑制剂、阴道用药史,3天内有性生活或阴道灌洗。
本研究项目符合《赫尔辛基宣言》中涉及人来源样本用于基础研究均签署知情同意书。本研究于2019年7月18日在泰国临床试验注册中心(https://thaiclinicaltrials.org)注册,注册号为TCTR20190718003。
1.3 方法 1.3.1 标本采集VVC组患者采用克霉唑治疗,NC组不进行任何干预。正常NC组每例患者采样1次。VVC组每例患者采样4次,分别为用药前1次,用药后第10天、30天、60天各1次采样。使用一次性棉签拭子在阴道下1/3处旋转取样,样品采集后转移至-80 ℃低温冰箱保存。
1.3.2 样本总DNA扩增测序使用QIAampⓇ DNA Mini Kit(Qiagen,德国)提取阴道分泌物中全部细菌总DNA,具体操作步骤参照说明书。采用NanodropND-2000微量紫外分光光度计(Thermo Fisher,美国)测定样本DNA的260 nm、280 nm的吸光值,计算DNA纯度和浓度,在-20 ℃下储存备用。用Ion 16STM Metagenomics kit (货号A26216)(Thermo Fisher,美国)试剂盒中自带的引物组16S rDNA V2-4-8和V3-6, 7-9的6对引物,以提取的DNA为模板进行普通聚合酶链式反应(polymerase chain reaction, PCR)扩增,制备测序基因文库,引物信息如下表 1所示。
| Name | Number | Sequence (5’-3’) |
| V2区通用引物对 | 63 F | GCAGGCCTAACACATGCAAGTC |
| 342 R | CTGCTGCSYCCCGTAG | |
| V4区通用引物对 | 515 F | GTGCCAGCAGCCGCGGTAA |
| 806 R | GGACTACCAGGGTATCTAATCCTGTT | |
| V8区通用引物对 | 1070 F | ATGGCTGTCGTCAGCT |
| 1392 R | ACGGGCGGTGTGTAC | |
| V3区通用引物对 | 341 F | ACTCCTACGGGAGGCAGCAGT |
| 518 R | ATTACCGCGGCTGCTGG | |
| V6、7区通用引物对 | 926 F | AACTCAAAGGAATTGACGG |
| 1369 R | GCCCGGGAACGTATTCACCG | |
| V9区通用引物对 | 1492 F | TACGGTACCTTGTTACGACTT |
| 1525 R | AAGGAGGTGTCCATCC |
使用Ion 16 sTM宏基因组学试剂盒(目录号A26216)对样本DNA进行文库制备。提取12.5 μL基因组DNA用于制备扩增子。试剂盒中的2个引物组被设计用于扩增细菌16 S区的相应高可变区。PCR程序如下:95 ℃预变性10 min,95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸20 s,25个循环后72 ℃延伸7 min。反应结束后,样品在-20 ℃下保存。大肠杆菌基因组DNA和水分别作为阳性和阴性对照。扩增产物在室温下放置30 min后用AgencourtⓇ AMPureⓇ XP珠粒(分类号A63881)(Beckman Coulter,美国)纯化。使用AgilentⓇ 2100 BioanalyzerⓇ仪器(Agilent,美国)和安捷伦Ⓡ高灵敏度DNA试剂盒(目录号5067-4626)分析纯化的PCR产物片段并进行定量。将每个样品的2组纯化扩增物进行等体积混合。使用Ion Plus Fragment Library试剂盒(目录号4471252)进行扩增末端修复,然后使用AgentcourtⓇ AMPureⓇ XP磁珠(目录号A63881)进行纯化。将Ion XpressTM Barcode Adapters 1-16试剂盒(类别号4471250)(Thermo Fisher,美国)添加到文库中进行连接反应。反应完成后须用AgentcourtⓇ AMPureⓇ XP磁珠(目录号A63881)纯化。使用Ion通用文库定量试剂盒(目录号A26217)通过qPCR测定文库浓度。使用Ion PGMTM Hi-QTM测序试剂盒(目录号A25592)(Thermo Fisher,美国)在Ion PGTMD系统(Life Technologies,美国)上对扩增的片段进行测序。
1.3.3 微生物学多样性分析测序后根据Barcord条形码区分不同的样本DNA reads。过滤掉低质量reads,利用Usearch软件对质控合格的高质量reads读数进行聚类分析,以根据97%相似性的标准获得生物多样性科学中对种群进行分类和研究的基本单元(operational taxonomic unit,OTU),并汇总到OTU丰度表中。使用Qiime软件根据OTU丰度表进行后续分析(http://qiime.org/home_static/DataFiles.html),在RDP分类器工具(http://rdp.cme.msu.edu/)、EzBioCloud 16S数据库(https://www.ezbiocloud.net/tools)和Greengenes数据库中对OTU进行物种注释;基于OTU和物种注释结果进行样品α多样性(物种复杂度)分析以及β多样性(组间物种差异)分析,各组数据之间的差异用非参数Mann-Whitney检验进行显著性差异分析,P<0.05表示差异具有统计学意义。
2 结果 2.1 样本信息本研究招募NC组患者27例,收集分泌物样本27个。招募VVC组患者18例,收集分泌物样本72个,测序样本72个,因样本中有嵌合体或者存在污染,剔除了18个样本,剩余54个样本。各样本的临床CST分型结果如表 1、表 2所示。NC组中62.9%处于稳态,29.6%处于转化态,7.4%处于失衡态。VVC组中24.0%处于稳态,74.1%处于转化态,1.9%处于失衡态。具体数据如表 2、表 3所示。
| NC组 | 年龄(岁) | CST分型 |
| NC-1 | / | Ⅰ |
| NC-2 | / | Ⅳ |
| NC-3 | / | Ⅲ |
| NC-4 | / | Ⅰ |
| NC-5 | 23 | Ⅲ |
| NC-6 | 35 | Ⅰ |
| NC-7 | 40 | Ⅲ |
| NC-9 | 18 | Ⅰ |
| NC-10 | 24 | Ⅰ |
| NC-11 | 27 | Ⅰ |
| NC-13 | 28 | Ⅰ |
| NC-14 | / | Ⅰ |
| NC-15 | 25 | Ⅴ |
| NC-16 | 26 | Ⅰ |
| NC-17 | 39 | Ⅲ |
| NC-18 | 25 | Ⅲ |
| NC-19 | / | Ⅳ |
| NC-20 | 26 | Ⅲ |
| NC-21 | 32 | Ⅰ |
| NC-22 | / | Ⅲ |
| NC-23 | / | Ⅰ |
| NC-24 | 27 | Ⅱ |
| NC-25 | 42 | Ⅲ |
| NC-26 | 31 | Ⅰ |
| NC-27 | 24 | Ⅰ |
| NC-29 | 36 | Ⅰ |
| NC-30 | / | Ⅰ |
| 注:“/”代表招募的患者年龄数据缺失。 | ||
| VVC组 | 年龄(岁) | CST分型 | |||
| m0 | m1 | m2 | m3 | ||
| VVC-1 | / | Ⅲ | / | / | / |
| VVC-2 | / | Ⅲ | Ⅰ | Ⅳ | / |
| VVC-3 | 32 | Ⅲ | / | / | / |
| VVC-4 | 24 | Ⅲ | / | Ⅰ | / |
| VVC-5 | 24 | Ⅲ | Ⅲ | Ⅲ | Ⅲ |
| VVC-6 | 28 | Ⅲ | Ⅲ | / | Ⅲ |
| VVC-7 | 26 | Ⅲ | Ⅲ | Ⅲ | Ⅲ |
| VVC-8 | 28 | Ⅲ | Ⅲ | Ⅲ | Ⅲ |
| VVC-9 | 32 | Ⅲ | Ⅲ | Ⅲ | Ⅲ |
| VVC-10 | 27 | / | / | / | Ⅲ |
| VVC-11 | 27 | Ⅲ | Ⅲ | Ⅲ | Ⅲ |
| VVC-12 | 33 | Ⅲ | Ⅳ | Ⅲ | Ⅲ |
| VVC-13 | 28 | Ⅰ | Ⅲ | Ⅰ | Ⅰ |
| VVC-14 | 25 | Ⅰ | Ⅰ | Ⅰ | Ⅰ |
| VVC-15 | / | Ⅲ | Ⅰ | Ⅲ | / |
| VVC-16 | 30 | Ⅲ | Ⅲ | Ⅲ | / |
| VVC-17 | 23 | Ⅰ | / | Ⅰ | Ⅰ |
| VVC-18 | 34 | Ⅲ | / | / | Ⅲ |
| 注:“/”代表相关数据缺失。 | |||||
NC组实际测序样本27个,共计1 987 994条序列,653个OTUs。NC组编号:NC 1~7、9~11、13~27、29、30。VVC组实际测序样本54个,共计4 183 919条序列,1 015个OTUs。VVC组编号:VVC1/m0,VVC2/m0-m2,VVC3/m0,VVC4/m0、m2,VVC5/m0-3,VVC6/m0/m1/m3,VVC7/m0-m3,VVC8/m0-m3,VVC9/m0-m3,VVC10/m3,VVC11/m0-3,VVC12/m0-3,VVC13/m0-m3,VVC14/m0-m3,VVC15/m0-m2,VVC16/m0-m2,VVC17/m0、m2、m3,VVC18/m0、m3为(m0表示用药前,m1表示用药后10天,m2表示用药后30天,m3表示用药后60天)。实际测序总样本数量为81个。共采集数据6 171 913条序列,平均值76 319条序列。
2.3 各组分泌物样本细菌群落多样性分析 2.3.1 NC组与VVC组阴道分泌物细菌群落组成分析NC组与VVC组样本的阴道分泌物样本中细菌分类在属水平上的分布如图 1所示。结果显示,77例样本(占总样本数的95.1%)中菌群组成以乳杆菌(Lactobacillus sp.)为主,乳杆菌的丰度在75.6%~98.2%。图 2显示NC组与VVC组81例阴道分泌物样本中细菌在种水平上的分布。其中NC组15例样本(占NC组样本总数的55.6%) 以卷曲乳杆菌(L. crispatus)为主,其丰度在56.7%~ 99.1%;1例样本以詹氏乳杆菌(L. jensenii)为主,丰度为95.2%;有3例样本中加德纳菌(Gardnerella sp.)的丰度在50%以上,其余8例样本(占NC组样本总数的29.6%)以惰性乳杆菌(L. iners)为主, 丰度在59.9%~97.2%。VVC组患者40例样本(占VVC组样本总数的74.1%)以惰性乳杆菌(L. iners)为主, 丰度在56.4%~98.3%;12例样本(占VVC组样本总数的74.1%)以卷曲乳杆菌(L. crispatus)为主, 丰度在63.7%~94.6%;图 3为VVC组样品18例样本治疗前后种分类水平的细菌分布,结果显示在抗真菌药物治疗后,细菌群落的结构组成并无显著差异。
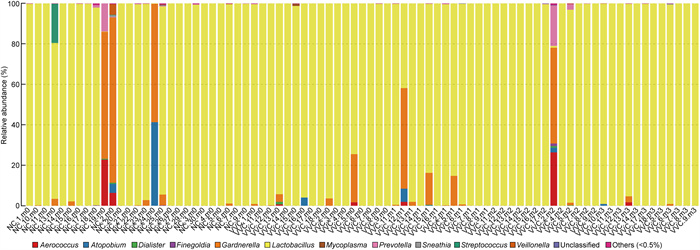
|
| 图 1 VVC与NC组阴道细菌属水平柱状图 Fig. 1 Histogram of vaginal bacteria at genus level of VVC group and NC group |
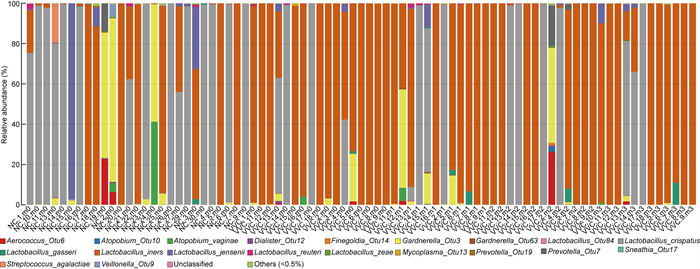
|
| 图 2 VVC与NC组阴道细菌种水平柱状图 Fig. 2 Histogram of vaginal bacteria at species level of VVC group and NC group |
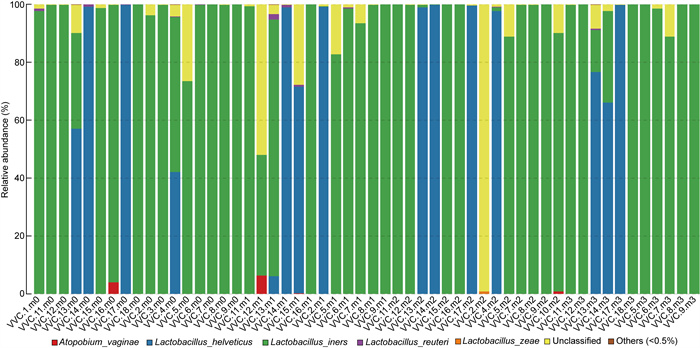
|
| 图 3 VVC组治疗前后阴道细菌种水平柱状图 Fig. 3 Histogram of vaginal bacteria at species level before and after treatment of the VVC group |
在VVC组中,对于VVC5、7、8、9、11、12、13、14共计8个病例,分别采集治疗前、治疗后10天、30天、60天的样本数据。从图 4可以看出,VVC8、9、11、12病例在抗真菌药物治疗后,阴道中以惰性乳杆菌(L. iners)为主,丰度在98%以上,细菌群落结构基本无变化。而VVC5样本在治疗前以L. iners、加德纳菌(Gardnerella sp)为主,抗真菌药物治疗后Gardnerella sp.减少,而L. iners丰度随着治疗时间的延长而增加,直到治疗60天,阴道内L. iners丰度达到99.1%。VVC7病例阴道内以L. iners为主,但是在抗真菌治疗后阴道菌群中L.gasseri的丰度增加。VVC13病例在治疗前阴道内以L.iners和L.crispatus为主,且L.crispatus的丰度高于L.iners,随着抗真菌药物治疗至10天,L.crispatus的丰度显著减少,治疗至30天L.crispatus的丰度增加,占有绝对优势,到达60天阴道菌群和未治疗前趋于一致。VVC14病例显示治疗前阴道以L.crispatus为主,抗菌治疗后基本保持不变。
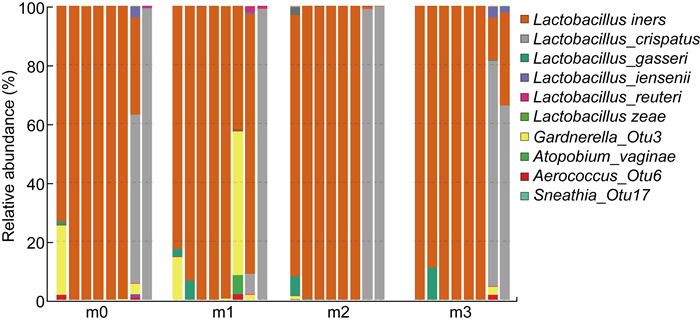
|
| 图 4 VVC5、7、8、9、11、12、13、14治疗前后阴道细菌种水平柱状图 Fig. 4 Histogram of vaginal bacteria at species level before and after treatment of VVC5, 7, 8, 9, 11, 12, 13, 14 |
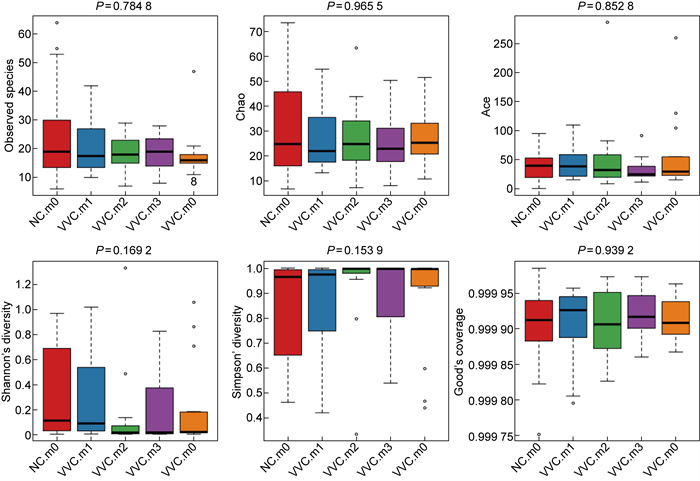
对NC组和VVC组Alpha多样性指数的分析结果(见图 5)显示,NC组VVCm0-m3样本数量依次为27、17、12、13、12(总计81个样本);序列总数依次是2 002 641,1 361 126,934 684,957 709,962 734(总计6 218 894条序列),Observed species指数显示VVCm0组的多样性小于NC组,治疗后VVC m1接近NC组,而VVC m3阴道细菌多样性又回归至治疗前的状态,VVC m2接近NC组,但NCm0/VVCm0-m3的5个分组之间不存在显著差异(P=0.784 8)。Chao指数显示,NC组均大于VVCm0-3组,但无显著性差异(P=0.965 5)。Ace指数显示,NC组的指数大于VVCm0-3组,但无显著性差异(P=0.852 8)。Shannon指数显示,NC组多样性大于VVCm0组,VVCm1阴道菌群多样性趋近NC组,VVCm2多样性低于NC组,回归至治疗前状态但无显著性差异(P=0.169 2)。Simpson指数与Shannon指数均显示,基本数据一致,无显著性差异(P=0.153 9)。Goods coverage指数反映了样本中微生物组成测序结果的真实性,81例样本阴道微生物测序深度覆盖率并无显著差异(P=0.939 2)。
|
| 图 5 VVC与NC组阴道细菌Alpha多样性指数分析 Fig. 5 Alpha diversity index analysis on vaginal bacteria of VVC group and NC group |
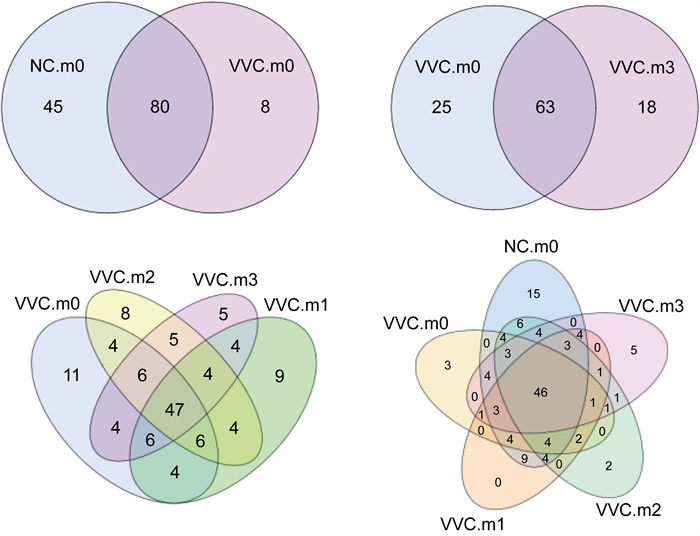
VVC组和NC组阴道分泌物样本细菌OTUs聚类Venn图如图 6所示。NC组和VVC m0组相比有80个OTUs重叠,除此外NC组OTU分类(45个)明显高于VVCm0组(8个)。VVC组在抗真菌治疗前后(m0与m3对比)有63个OTUs的重叠,除此外OTUs分类从25降低至18。在VVC组的抗真菌治疗过程中,从用药前m0、到用药后m1、m2、m3组各组的OTUs有不同程度的重叠,但纳入NC组分析后,总体结果显示,对比NC组,抗真菌治疗后样本中OTUs数目减少,NC组阴道菌群OTUs明显高于VVC组(P<0.05)。
|
| 图 6 VVC与NC组阴道细菌OTUs聚类韦恩图 Fig. 6 Venn diagram of bacterial OTUs clustering of VVC group and NC group |
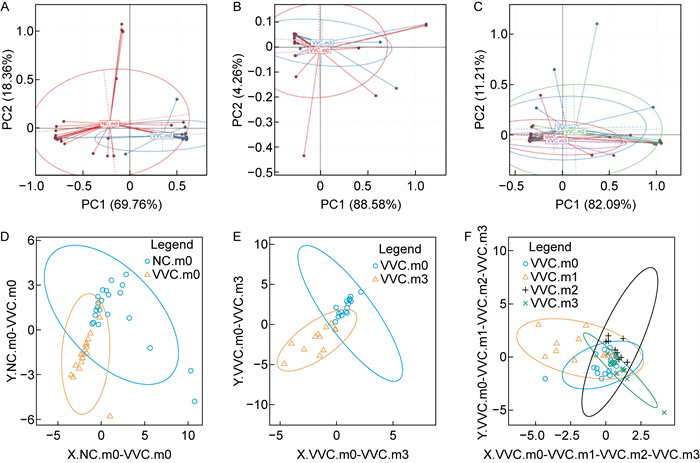
VVC组和NC组阴道分泌物样本细菌聚类PCA与PLS-DA分析图如图 7所示,通过绘制PCA矩阵图分析阴道菌群β多样性,结果显示VVC组的样本菌群结构组成显著区别于NC组(P<0.05);VVC组中m0-m3四组样本具有相似的细菌多样性结构组成,抗真菌药物治疗前后m0与m3样本的菌群结构组成没有显著差异。
|
| A~C:PCA矩阵图;D~F:OTU based PLS-DA分析。 图 7 VVC和NC组细菌聚类PCA与PLS-DA分析 Fig. 7 Bacterial cluster PCA and PLS-DA analysis of VVC group and NC group |
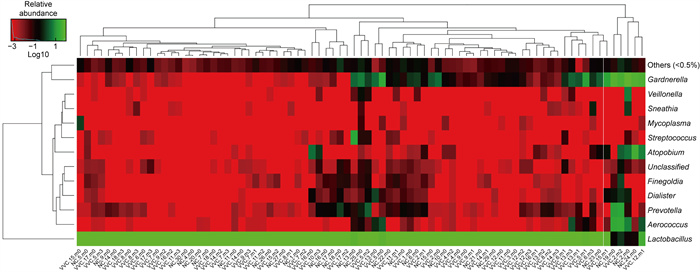
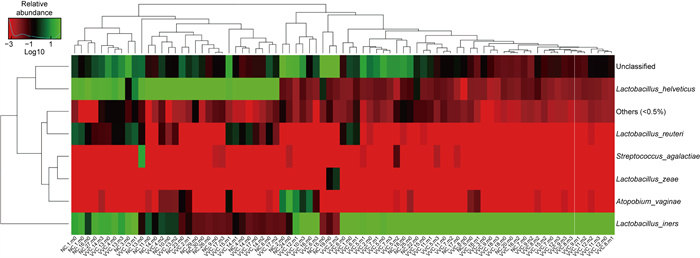
样本菌群热度图(见图 8)分析显示,2组样本中以乳杆菌属的丰度最高,为主要优势菌群,少部分NC组和VVC组的样本以加德纳菌属(Gardnerella sp.)、阿托波氏菌属(Atopobium sp.)、普雷沃氏菌属(Prevotella sp.)、气球菌属(Aerococcus sp.)等条件致病菌为主。图 8中81例样本在Genus属分类水平中细菌物种的热度图(heatmap)所示,77例样本(占样本总数95.1%)中菌群组成以乳杆菌(Lactobacillus sp.)为主,在以Lactobacillus sp.乳杆菌属为主的阴道环境中,其他致病细菌含量较少。当阴道内加德纳菌属占主导地位时,普雷沃氏菌属、气球菌属的丰度也相应增加。图 9显示81例样本在种分类(species)水平中细菌物种的heatmap,结果显示VVC组与NC组在species分类水平上存在着一定的差异,NC组样本以卷曲乳杆菌(L. crispatus)为主,VVC组样本以惰性乳杆菌(L. iners)为主。L. iners和L. crispatus同属乳杆菌属(Lactobacillus sp.),在以乳杆菌为优势菌群的阴道微环境中,无发病的NC组和真菌感染的VVC组在乳杆菌种分布上存在显著差异,L. iners丰度增加,在VVC组样本中占主导地位,与VVC的发病相关,并具有一定的指示作用。抗真菌药物治疗后60天,阴道菌群的组成未发生明显改变。
|
| 图 8 VVC和NC组阴道细菌属水平的热度图 Fig. 8 Heatmap of vaginal bacteria at genus level of VVC group and NC group |
|
| 图 9 VVC和NC组阴道细菌属种分类水平热度图 Fig. 9 Heatmap of vaginal bacteria at genus level of VVC group and NC group |
女性阴道是一个开放环境的复杂微生态系统,由多微生物群落与人体激素调节、局部免疫机制共同维持其平衡,雌激素促使阴道上皮细胞糖原增多,而孕激素促使阴道表层细胞脱落释放细胞内糖原,为阴道菌群的生长提供营养来源[7]。健康女性阴道微生态菌群(vaginal microbiota,VMB)维持“阴道自净作用”[8]。微生态稳定性VMB可分为以下3个级别。①VMB Ⅰ级(稳定态)包括3个分型:CST Ⅰ型(L.crispatus优势菌群)、CST Ⅱ型(L.gasseri优势菌群)、CST Ⅴ型(以L.jensenii为优势菌群)。②VMB Ⅱ级(过渡态)是介于健康态与转化态之间,CST Ⅲ型(L.iners优势菌群)。③VMB Ⅲ型(失衡态)也称BV态(bacterial vaginosis,BV)[9]。阴道菌群VMB分型中以L. iner为主的CST Ⅲ型被划分为阴道微生态过渡态。在本研究中,通过高通量测序证实了VVC人群与健康人群在乳杆菌种分类上存在显著差异。VVC发病时惰性乳杆菌L.iners的丰度增加,惰性乳杆菌对VVC的发病并具有指示作用。抗真菌药物治疗后60天阴道菌群组成未有明显变化,不能促使阴道菌群向CST Ⅰ型稳定态转变,这或许成为VVC复发的重要因素之一。
阴道内环境的健康状态与不同种的乳杆菌定植有关,正常阴道菌群以Lactobacillus sp.为主,卷曲乳杆菌(L.crispatus)通过产生有机酸、过氧化氢、细菌素等代谢产物为阴道提供健康环境,抑制病原菌的增殖。复发性RVVC患者阴道菌群的丰富度明显降低,以L.iners为优势菌属,而L.crispatus的丰度明显减少[10]。阴道内假丝酵母菌以菌丝体的形态大量繁殖,从而形成VVC[11]。假丝酵母菌属能够产生曲霉菌素,抑制L.crispatus的生长,而L.iners与其他乳杆菌相比有独特的菌种特性,其菌体形态和基因组相对于其他乳杆菌较小,革兰氏阴性,产细胞溶素,体外培养可见溶血现象。L. iners具有较强的增殖与黏附能力,容易破坏细胞外基质,破坏阴道上皮机械结构的完整性,从而促进真菌菌丝相生长向阴道上皮侵入,其存在与阴道微生态紊乱有关[12]。本研究显示L.iners为主导的阴道环境与VVC感染的发生密切相关,当患者阴道菌群以L.iners为主,未能抑制VVC发病,这说明L. iners存在于阴道并不能为阴道局部环境提供保护,在感染发生的时候,L. iners因其特殊的菌种特性能够适应感染状态且与病原菌共存。VVC感染患者在接受抗真菌药物治疗后无法恢复到以卷曲乳杆菌(L.crispatus)为主导的CST Ⅰ型稳态,这一结论能够为临床预防与治疗VVC提供依据,可以推论感染发生后阴道微生态的恢复须外源益生活菌的介入。研究表明,对VVC治愈患者的样本菌群结构进行XGbosst分析和随机森林分析,结果显示:乳杆菌(Lactobacillus sp.)与肠球菌(Enterococcus sp.)之间的菌群比例会影响治疗结果[13]。比较治疗前后的样本菌群结构,治疗后Enterococcus sp.的丰度在第10天增加、第30天减少。Lactobacillus sp.在第7天丰度增加[14]。在VVC发病人群的治疗中,肠球菌(Enterococcus sp.)在抗真菌治疗之后或许也能为L.crispatus恢复提供条件。
L.iners可能存在的机制是促进假丝酵母菌黏附、侵袭上皮细胞,调节菌丝相调节凝集素AIS3、Hyr1的表达,使得假丝酵母菌与阴道上皮的黏附,从而削弱VVC的治疗效果[15]。阴道假丝酵母菌形成生物膜后毒力因子增强,致病菌生物膜内部创造一个营养饥饿环境以调节Phr1、Ph2来适应外界pH值的变化[16-17]。同时,阴道假丝酵母菌能够使用糖原作为营养物质,并消耗L.iners产生的乳酸[18]。结合本研究分析,VVC的临床治疗单独依靠抗真菌药物存在一定的弊端,可能首次抗真菌治疗效果较好,但是易导致较高的VVC复发率,耐药也是难以避免的问题,如何恢复阴道菌群组成,促使阴道微生态环境维持在健康的稳态,是预防和控制感染发生的关键。
4 结论惰性乳杆菌(L.iners)虽然在分类地位上属于乳杆菌属,但在维护阴道稳定态的过程中并未起到与卷曲乳杆菌(L.crispatus)等相同的促进作用,由于其特殊的菌体特性,L.iners在健康的状态和阴道炎症发生时都有较强的生存力,由于这种生存力,使得以L.iners为主的阴道环境更利于假丝酵母菌的生长,更有利于菌丝的发生和侵袭,从而形成感染与炎症。因此,推断促进阴道内L.crispatus增加或抑制L.iners定植,可能是治愈复发性VVC的一个关键因素。此次研究显示,VVC患者症状明显,阴道菌群失调,阴道菌群结构中L.iners丰度增多、L.crispatus丰度减少,抗真菌药物治疗对于菌群结构的改变效果不明显。因此,通过补充相关外源益生菌以促进L.crispatus丰度增加,或抑制L.iners定植,有望降低VVC的发病率。惰性乳杆菌(L.iners)在阴道菌群中的比例具有指示VVC发病的潜在临床指征,期望通过更深入的研究,阐明VVC的发病机制,为外阴阴道假丝酵母菌病的临床预防和治疗提供更有效的手段。
| [1] |
郑皓, 李文革, 古文鹏. 光滑假丝酵母菌和热带假丝酵母菌环境分离株的氟康唑敏感性与多位点序列分型分析[J]. 疾病监测, 2018, 33(12): 1042-1047. [DOI]
|
| [2] |
Farr A, Effendy I, Frey TB, Hof H, Mayser P, Petricevic L, Ruhnke M, Schaller M, Schaefer AP, Sustr V, Willinger B, Mendling W. Guideline: vulvovaginal candidosis (AWMF 015/072, level S2k)[J]. Mycoses, 2021, 64(6): 583-602.
[DOI]
|
| [3] |
邵明琨. 不同侵袭力白假丝酵母菌对RVVC阴道局部免疫的影响[D]. 昆明: 昆明医科大学, 2022.
|
| [4] |
范琳媛, 白会会, 刘朝晖. 不同形态真菌在外阴阴道假丝酵母菌病诊治中的价值探讨[J]. 中国实用妇科与产科杂志, 2021, 37(8): 858-861. [DOI]
|
| [5] |
高聪莉, 刘丹, 邢丽枝. 乳杆菌制剂治疗外阴阴道念珠菌病的研究进展[J]. 中国真菌学杂志, 2022, 17(1): 59-63. [DOI]
|
| [6] |
中华医学会妇产科学分会感染性疾病协作组. 阴道微生态评价的临床应用专家共识[J]. 中华妇产科杂志, 2016, 51(10): 721-723. [DOI]
|
| [7] |
刘晓娟. RVVC危险因素及乳杆菌数量变化的研究[D]. 天津: 天津医科大学, 2016. [URI]
|
| [8] |
沈彩糯, 王巧亚, 洪威阳. 阴道微生态改变与高危人乳头瘤病毒感染的关系研究[J]. 现代实用医学, 2021, 33(12): 1662-1664. [DOI]
|
| [9] |
马薇, 金措. 女性一生不同阶段阴道微生态菌群特征研究进展[J]. 中国实用妇科与产科杂志, 2016, 32(8): 817-820. |
| [10] |
马啸, 蔡慧华, 何彦. 复发性外阴阴道假丝酵母菌病患者阴道微生物的物种组成及其动态变化[J]. 南方医科大学学报, 2017, 37(2): 192-198. [DOI]
|
| [11] |
欧丽滢, 周琛斐, 蔡慧华. RVVC患者阴道微生物的物种组成及其变化情况[J]. 新医学, 2022, 53(6): 441-447. |
| [12] |
肖卓然, 白会会, 刘朝晖. 惰性乳杆菌对女性生殖道健康影响的研究进展[J]. 中国微生态学杂志, 2022, 34(11): 1348-1351. [DOI]
|
| [13] |
Xiao BB, Niu XX, Han N, Wang B, Du PC, Na RS, Chen C, Liao QP. Predictive value of the composition of the vaginal microbiota in bacterial vaginosis, a dynamic study to identify recurrence-related flora[J]. Sci Rep, 2016, 6: 26674.
[DOI]
|
| [14] |
Xiao BB, Wu C, Song WF, Niu XX, Qi nN, Liu ZH, Xu Q, Xu Q. Association analysis on recurrence of bacterial vaginosis revealed microbes and clinical variables important for treatment outcome[J]. Front Cell Infect Microbiol, 2019, 9: 189.
[DOI]
|
| [15] |
姜彤, 陈昌斌. 念珠菌适应宿主环境压力的共生机制研究进展[J]. 菌物学报, 2020, 39(11): 2131-2148. [DOI]
|
| [16] |
Zhu B, Tao Z, Edupuganti L, Serrano MG, Buck GA. Roles of the microbiota of the female reproductive tract in gynecological and reproductive health[J]. Microbiol Mol Biol Rev, 2022, 86(4): e0018121.
[DOI]
|
| [17] |
刘胡林, 徐兴然, 凌开建. 人生殖道源乳酸杆菌的筛选及在小鼠阴道假丝酵母病模型中的应用评价[J]. 微生物学报, 2022, 62(11): 4141-4154. |
| [18] |
Rani P, Tiwari SK. Health benefits of bacteriocins produced by probiotic lactic acid bacteria[J]. Microbial Biomolecules, 2023, 97-111.
[DOI]
|
 2024, Vol. 19
2024, Vol. 19


