2. 复旦大学生命科学院, 上海 200441
2. School of Life Sciences, Fudan University, Shanghai 200438, China
蘑菇家族成员2(Shroom family member 2,Shroom2)基因位于X染色体,跨度约160 kb,包含10个外显子[1]。SHROOM2蛋白是蘑菇家族成员之一,与家族内其他成员一样,均含有PDZ、ASD1及ASD2三个保守结构域。SHROOM2位于质膜和皮质肌动蛋白(F-actin),在大多数上皮细胞的细胞-细胞接触的顶端边界中均有表达[2]。据报道,SHROOM2参与调节内皮细胞的肌动蛋白骨架重塑[3],其中SHROOM 2的ASD2结构域可以直接与Rho相关蛋白激酶(Rho-associated protein kinase,ROCK)反应,从而激活细胞-细胞黏附部位的肌凝蛋白VIIa (myosin VIIa),继而影响内皮细胞的发芽、迁移和血管生成[4]。此外,SHROOM2还参与RhoR-ROCK诱导的应力纤维形成和局灶黏附,并且可抑制上皮-间充质转化(epithelial-to-mesenchymal transition,EMT),从而抑制鼻咽癌上皮细胞的转移[5]。研究表明,SHROOM 2蛋白可以影响血管生成[4]、肿瘤转移[5]、视网膜上皮色素沉着[6],然而,关于SHROOM2蛋白与免疫功能的关系研究,尚未见文献报道。
血吸虫病是由血吸虫属的复殖吸虫引起的人类慢性蠕虫病,流行于78个国家与地区,严重影响疫区人民健康与经济发展[7-8]。在我国,尽管近年来血吸虫病防控取得了显著进展,部分流行区已达到传播阻断或消除的标准,但日本血吸虫仍在某些地区持续流行,并对当地居民的健康构成威胁,因此血吸虫病仍是需要关注的公共卫生问题[9]。日本血吸虫寄生在肝门静脉后,雌雄虫合抱并发育成熟,随后雌虫产卵。虫卵沉积于肝脏中发育成熟,会释放虫卵抗原,诱导宿主免疫应答并诱导肉芽肿形成,在宿主体内引起不同程度的组织损伤。这一过程涉及多个免疫细胞群和细胞活化、分化、扩展及迁移的多个阶段[10-11]。虫卵肉芽肿的形成不仅是宿主对虫卵的一种免疫反应,有利于破坏和清除虫卵,而且也可能导致组织损伤[12-13]。这种由虫卵诱导的肉芽肿反应是一个独特的免疫研究模型。
课题组前期研究偶然发现,Shroom2缺失的小鼠在感染血吸虫后,其死亡率远高于野生型小鼠。经文献检索,目前尚无研究报道Shroom2基因与日本血吸虫感染之间的关系。这一发现为本研究提供了重要的创新点,并为探索寄生虫感染中的免疫调控机制提供了新视角。基于这一发现,本研究提出了SHROOM 2在宿主抵抗血吸虫感染免疫中发挥作用的假设。本研究使用Shroom2基因敲除(knockout,KO)小鼠构建日本血吸虫感染模型,探究Shroom2缺失是否会加重日本血吸虫引发的宿主病理损伤并加速宿主死亡。
1 材料和方法 1.1 实验动物野生型(wild type,WT)C57BL/6小鼠,6~8周龄,体重20±2 g,购自上海斯莱克实验动物有限责任公司[动物生产许可证号:SCXKZ(沪2018-0004)]。KO小鼠由Cyagen Biosciences Inc.构建,在复旦大学生命科学院生物安全Ⅱ级动物房饲养繁育。
1.2 主要试剂日本血吸虫(中国大陆株)尾蚴由中国疾病预防控制中心寄生虫病预防控制所提供。本研究遵循中国疾病预防控制中心国家寄生虫病预防控制所实验动物福利审查委员会批准的标准(批准号:IPD-2020-10)。主要试剂及仪器:丙氨酸转氨酶(alanine aminotransferase,ALT)酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒(Elabscience,中国);ELISA酶标仪(Synergy2;Biotek,美国);血液高容量分析仪(DxH900;Beckman Coulter,美国)。
1.3 方法 1.3.1 构建Shroom2敲除小鼠Shroom2敲除小鼠的构建由Cyagen Biosciences Inc.完成。将野生型C57BL/6小鼠的Shroom2基因mRNA和Cas9 mRNA共注射到小鼠受精卵中,产生靶向敲除后代,通过聚合酶链式反应(polymerase chain reaction,PCR)鉴定F0代小鼠(基因敲除小鼠构建方法及鉴定结果详见图 1)。扩增产物位于Shroom2基因的2~4号外显子区域,扩增片段长度分别为685 bp(KO小鼠)和1 400 bp(WT小鼠)。所使用的引物序列如下:正向引物(forward primer) 5’-CACAAGTGCTACTAAAACAAGG~TGC-3’,反向引物(reverse primer) 5’-TGAA~CATTCCTGAGCCATAGCAAG-3’。PCR扩增条件如下:94 ℃预变性3 min,随后进行35个循环,包括94 ℃变性30 s、60 ℃退火35 s和72 ℃延伸35 s,最终72 ℃延伸5 min。
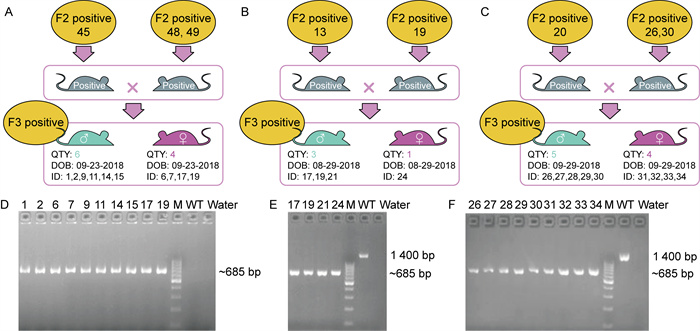
|
| A-C: Flow chart of the hybridization of homozygous KO mice. D-F: The results of KO mouse genotype identification. Positive: Mice identified as KO mice by genotyping. QTY: The number of mice in each batch. DOB: The birth date of the mice. 图 1 KO小鼠的育种方案及基因型鉴定 Fig. 1 Breeding scheme and genotype identification of KO mice |
设置WT未感染组、KO未感染组、WT感染组与KO感染组,WT未感染组有4只小鼠,KO未感染组有7只小鼠,其余各感染组每组不少于15只小鼠,均为雄性。将感染组小鼠腹部朝上固定于小鼠固定板上,剔除腹毛,裸露腹部皮肤,镊子夹取洁净的盖玻片取尾拗,于显微镜下计数,采用腹部贴片法将每只小鼠感染30±2条,然后将盖玻片贴在小鼠剃毛后的腹部,15~20 min后去除盖玻片。将感染后的小鼠置于P2级动物房饲养并密切观察,记录死亡情况。
1.3.3 感染小鼠肝功能检测密切观察感染小鼠的生存情况,当KO感染组小鼠处于濒死状态时留取样本,同时取状态良好的WT感染组和KO感染组小鼠作为对照。所有小鼠均使用摘眼球取血0.5~1 mL,静置数小时后3 000 r/min离心15 min,小心取上清液移至新EP管中并置于-80 ℃冰箱保存备用。使用ELISA试剂盒检测小鼠血清ALT的浓度,具体操作方法参考试剂盒说明书。使用酶联免疫吸附测定仪在450 nm处读取样品光密度(optical density, OD)值,用标准品制作标准曲线后计算样品浓度。
1.3.4 感染小鼠肝脏化学染色分别在小鼠感染后第35天和第49天断颈处死小鼠(每组n>3只),取小鼠右上叶肝脏,置于多聚甲醛浸泡24 h后,送至武汉塞维尔生物科技有限公司制作切片并进行苏木精-伊红染色(hematoxylin-eosin staining,HE),置显微镜下观察分析。对观察期内KO感染组濒死小鼠和同时期状态良好的WT感染组小鼠亦采用上述方法提取肝脏组织进行化学染色分析。
1.3.5 小鼠血常规检测在感染后第35、49天取各组小鼠颌下静脉血500 μL,置于EDTA抗凝真空采血管中,用1×磷酸缓冲盐溶液(phosphate buffered saline,PBS) 500 μL稀释,上下颠倒混匀,用血液高容量分析仪进行检测分析。
1.3.6 统计学分析实验数据使用Graphpad Prism9.0软件进行统计分析并作图,数据采用均数±标准差的形式表示,组间比较采用单因素方差(one-way ANOVA)分析,生存率分析采用Long-rank(Mantel-Cox) test分析。P<0.05时,代表组间比较的差异有统计学意义。
2 结果 2.1 KO小鼠感染血吸虫后在肉芽肿急性期的死亡率显著增加WT组感染日本血吸虫后第51天仅死亡1只小鼠,而KO组在感染后第45~52天累计死亡7只。实验结果显示,KO感染组小鼠在感染日本血吸虫后的死亡率显著高于WT感染组小鼠(P=0.004 8),且死亡主要发生在感染后的第6至第7周。这一时期恰逢虫卵诱导的肉芽肿炎症反应的高峰期及维持期,通常被认为是感染的急性期[14-15]。在此阶段,宿主免疫系统对虫卵抗原产生强烈的炎症反应,诱导肉芽肿形成并引发组织损伤[16]。因此,Shroom2缺失可能导致宿主在急性期的免疫反应失衡,从而加剧病理损伤和死亡风险(详见图 2)。
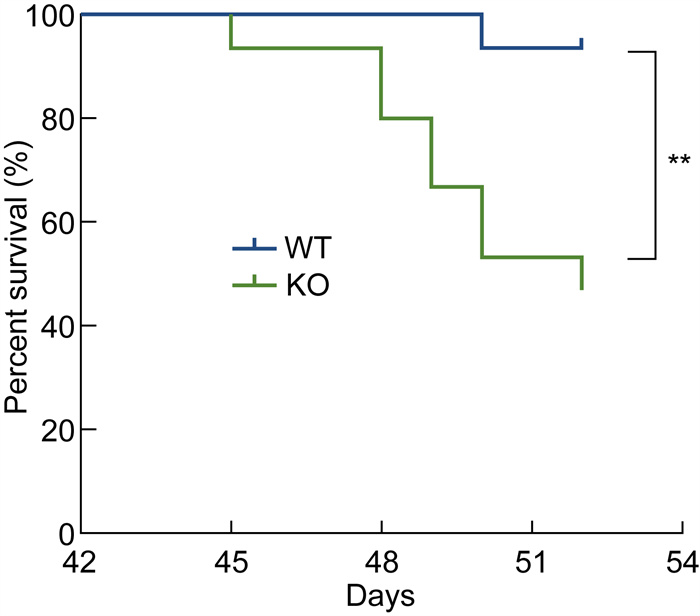
|
| WT: wild type; KO: knock out; dpi: days post-infection. * *: P=0.004 8. 图 2 感染后WT和KO小鼠的生存分析 Fig. 2 Survival analysis of WT and KO mice post-infection |
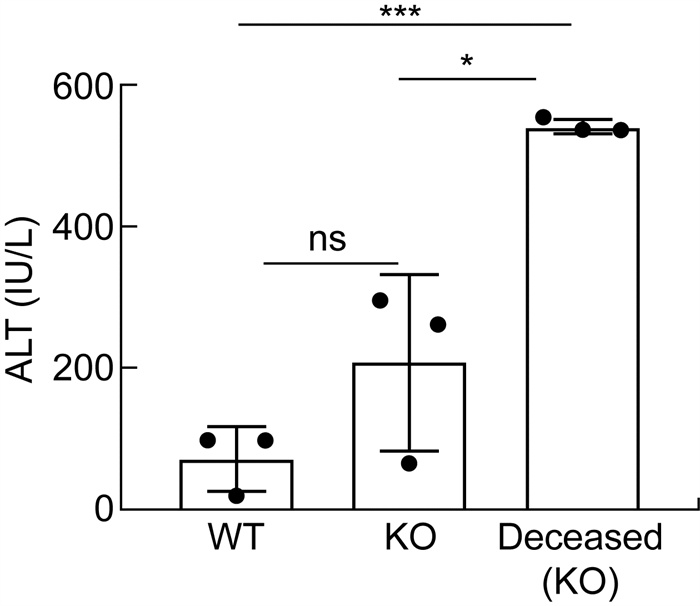
感染后第35天和第49天分别提取WT感染组和KO感染组小鼠的肝脏组织,并进行HE染色分析。如图 3所示,尽管2组小鼠感染后第49天的肝脏组织切片未见显著差异,但是在感染第35天时,KO感染组小鼠肝脏中的虫卵病灶周围存在更多的炎症细胞。除此之外,本研究在濒死的KO感染组小鼠(感染后第45天)肝脏样本中发现,即使肝脏虫卵肉芽肿尚处于早期阶段,肝小叶中的肝细胞已出现核增大和核深染的情况,这提示可能存在肝细胞水肿或炎症反应。在非虫卵肉芽肿的肝小叶中还可观察到弥漫性出血(详见图 4)。如图 5所示,WT感染组小鼠的血清ALT平均值约为50 U/L,而KO感染组显著升高至约200 U/L,濒死的KO感染组小鼠血清ALT水平进一步升高至约500 U/L,与WT感染组小鼠的血清ALT相比有显著性差异(P<0.001)。这些结果提示,急性肝损伤可能是导致KO感染组小鼠急性死亡的重要原因。
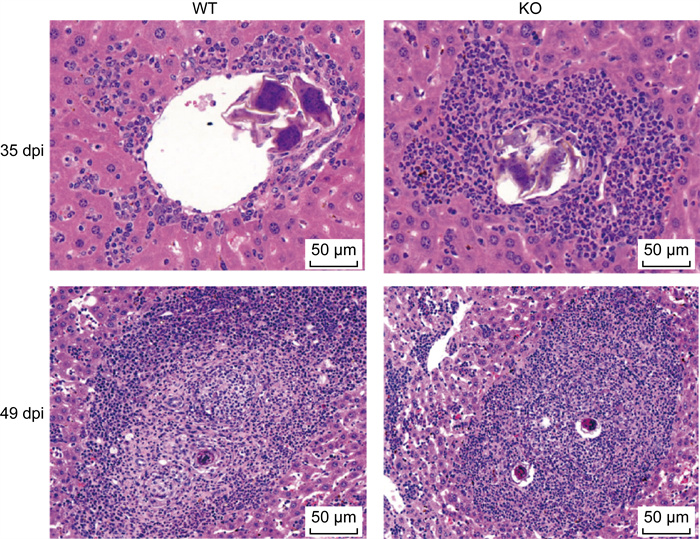
|
| WT: wild type; KO: knock out; dpi: days post-infection. 图 3 WT组和KO组小鼠感染日本血吸虫后第35天和49天肝脏肉芽肿的组织学分析 Fig. 3 Histological analysis of liver granulomas in WT and KO mice at 35 and 49 days post-infection |
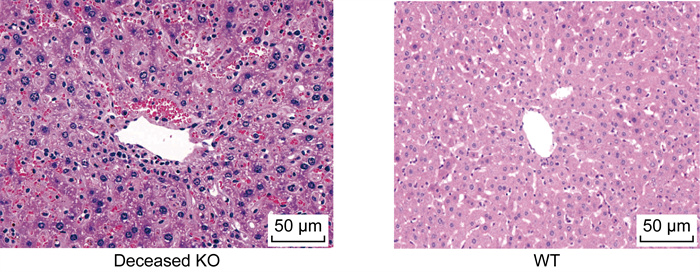
|
| WT: wild type; KO: knock out. 图 4 濒死KO小鼠及WT感染小鼠的肝脏组织学分析 Fig. 4 Liver histology of deceased KO mice and WT-infected mice |
|
| *: P=0.015 1; * * *: P = 0.000 8. 图 5 WT感染组、KO感染组及濒死KO小鼠的血清ALT水平 Fig. 5 Serum ALT levels in WT-infected, KO-infected and deceased KO mice |
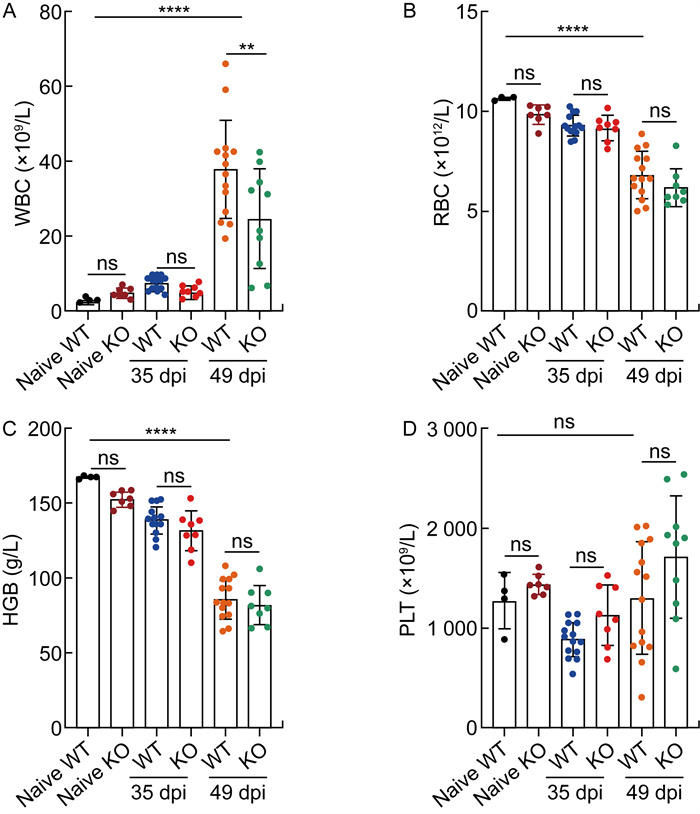
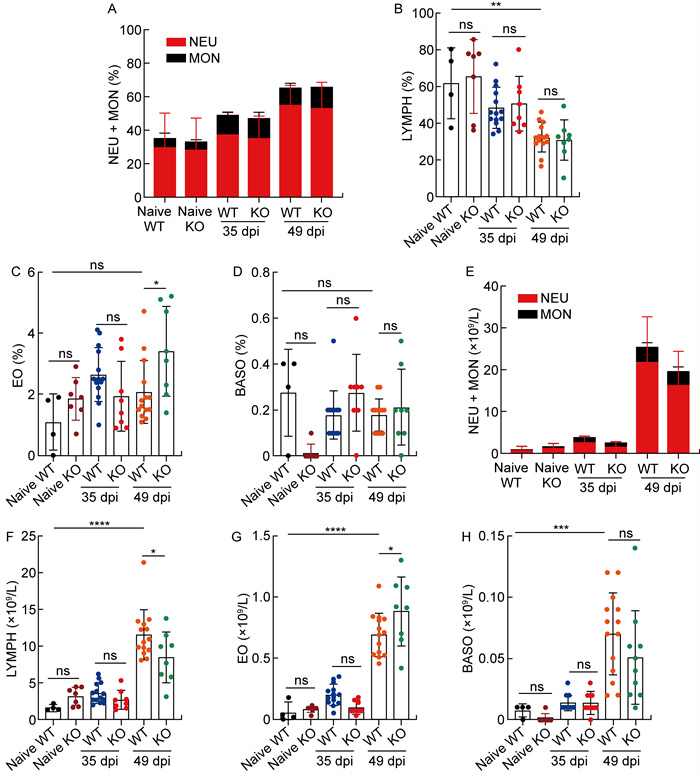
本研究进一步分析了WT未感染组、KO未感染组、WT感染组及KO感染组小鼠在感染后第35天和第49天的外周血血常规检测结果。在2组未感染小鼠中,小鼠的白细胞计数、红细胞计数、血红蛋白、血小板计数、中性粒细胞计数、单核细胞计数、淋巴细胞计数、嗜酸性粒细胞计数及嗜碱性粒细胞计数的检测结果均无显著差异(详见图 6、图 7)。在感染后第35天,2组小鼠的白细胞计数无明显差异。感染后第49天,2组小鼠的白细胞计数均显著升高,但KO感染组小鼠的白细胞计数(24.55×109/L)显著低于WT感染组小鼠(36.11×109/L, P<0.01);而红细胞计数、血红蛋白及血小板计数在2组感染小鼠之间无显著差异(详见图 6)。进一步分析显示,尽管淋巴细胞比例在2组感染小鼠之间未表现出显著差异,但KO感染组小鼠的淋巴细胞计数(7.75×109/L)显著低于WT感染组小鼠(11.70×109/L,P<0.05),而KO感染组小鼠的嗜酸性粒细胞比例(3.44%)及计数(0.82×109/L)均显著高于WT感染组小鼠(2.14%,0.69×109/L,P<0.05)。此外,WT感染组与KO感染组小鼠的中性粒细胞和单核细胞无显著差异(详见图 7)。这些结果提示,Shroom2基因缺失可能导致小鼠免疫调控功能紊乱,从而加剧了小鼠对血吸虫感染的易感性和病程的严重性。
|
| A: White blood cell (WBC) count. B: Red blood cell (RBC) count. C: Hemoglobin (HGB) concentration. D: Platelet (PLT) count. dpi: days post-infection. ns: no significance; * *: P<0.01; * * * *: P<0.000 1. 图 6 感染后第35天和第49天小鼠的血常规检测结果 Fig. 6 Complete blood count analysis in WT and KO mice at 35 and 49 days post-infection |
|
| A: Neutrophil (NEU) and monocyte (MON) proportions. B: Lymphocyte (LYMPH) percentage. C: Eosinophil (EO) percentage. D: Basophil (BASO) percentage. E-H: Absolute counts of NEU+MON, LYMPH, EO, and BASO. dpi: days post-infection. ns: no significance; *: P<0.05; * *: P<0.01; * * * *: P<0.000 1. 图 7 感染后第35天和第49天各组小鼠的差异性血细胞群体分析 Fig. 7 Differential blood cell population analysis in WT and KO mice at 35 and 49 days post-infection |
SHROOM2是一种关键的细胞骨架调控蛋白,已知其在内皮细胞和上皮细胞的应力纤维形成及细胞间黏附中发挥重要作用[4, 17]。然而,Shroom2基因在调节宿主免疫反应中的作用尚未被研究。本研究发现Shroom2基因缺陷小鼠感染日本血吸虫后肝脏病理显著加重损伤,且死亡风增加险,这提示SHROOM2蛋白可能通过调节炎症反应或细胞骨架重塑在免疫反应中发挥重要作用。
Shroom2敲除导致小鼠在血吸虫感染急性期肝脏出现明显的炎症反应,肝脏病理损伤加重,死亡率增加,这可能与Shroom2缺失导致宿主对感染的免疫反应失调密切相关。SHROOM2蛋白可能在调控细胞骨架的同时,通过影响细胞间黏附和信号传导,间接调节免疫细胞的功能,从而影响宿主的免疫反应。例如,Shroom2缺失可能导致巨噬细胞或其他免疫细胞的迁移和功能异常,从而加剧感染相关的组织损伤。嗜酸性粒细胞在抗寄生虫感染中的作用已被广泛研究,其表达增加通常与严重的炎症反应相关[18]。本研究中,Shroom2敲除小鼠感染日本血吸虫尾蚴后,外周血嗜酸性粒细胞数量显著增加,这进一步提示SHROOM2蛋白在调节免疫反应中的重要作用。SHROOM2蛋白可能通过调控免疫细胞的活化或迁移,间接影响感染部位的炎症反应程度。这些发现表明,SHROOM 2可能不仅在维持细胞骨架的完整性中发挥重要作用,而且可能通过调节特定免疫细胞的行为来影响宿主对感染的应答。
本研究首次揭示了Shroom2基因在宿主免疫反应中的关键作用,特别是在抗日本血吸虫感染中的重要性。这一发现为未来的免疫治疗提供了新的视角,并可能为血吸虫病的治疗策略提供新的潜在靶点。尽管本研究首次揭示了Shroom2基因在宿主免疫反应中的关键作用,但仍存在一定的局限性。例如,本研究尚未对小鼠组织和血清中的关键炎症因子(如IL-6、TNF-α、IFN-γ)进行检测,无法全面揭示Shroom2基因缺失对炎症因子表达的影响。此外,免疫细胞亚群的具体变化(如巨噬细胞、嗜酸性粒细胞的功能及迁移特性)尚未通过流式细胞术等手段进行系统分析。本研究目前也尚未开展针对SHROOM2下游信号通路的具体研究,但基于现有数据,初步推测其可能通过RhoA-ROCK信号通路调控免疫细胞的迁移和活性。这些局限性在一定程度上限制了本研究对SHROOM2在免疫调控中具体机制的理解。未来的研究重点是进一步明确SHROOM2在不同类型免疫细胞中的特定功能,并探索寄生虫感染过程中其在调控细胞骨架及免疫细胞行为中所发挥的作用,以揭示该蛋白在免疫调节网络中的复杂作用机制。
| [1] |
Schiaffino MV, Bassi MT, Rugarli EI, Renieri A, Galli L, Ballabio A. Cloning of a human homologue of the Xenopus laevis APX gene from the ocular albinism type 1 critical region[J]. Hum Mol Genet, 1995, 4(3): 373-382.
[DOI]
|
| [2] |
Etournay R, Zwaenepoel I, Perfettini I, Legrain P, Petit C, El-Amraoui A. Shroom2, a myosin-VIIa-and actin-binding protein, directly interacts with ZO-1 at tight junctions[J]. J Cell Sci, 2007, 120(Pt 16): 2838-2850.
[DOI]
|
| [3] |
Dietz ML, Bernaciak TM, Vendetti F, Kielec JM, Hildebrand JD. Differential actin-dependent localization modulates the evolutionarily conserved activity of Shroom family proteins[J]. J Biol Chem, 2006, 281(29): 20542-20554.
[DOI]
|
| [4] |
Farber MJ, Rizaldy R, Hildebrand JD. Shroom2 regulates contractility to control endothelial morphogenesis[J]. Mol Biol Cell, 2011, 22(6): 795-805.
[DOI]
|
| [5] |
Yuan J, Chen L, Xiao J, Qi XK, Zhang J, Li X, Wang Z, Lian YF, Xiang T, Zhang Y, Chen MY, Bei JX, Zeng YX, Feng L. SHROOM2 inhibits tumor metastasis through RhoA-ROCK pathway-dependent and-independent mechanisms in nasopharyngeal carcinoma[J]. Cell Death Dis, 2019, 10(2): 58.
[DOI]
|
| [6] |
Fairbank PD, Lee C, Ellis A, Hildebrand JD, Gross JM, Wallingford JB. Shroom2 (APXL) regulates melanosome biogenesis and localization in the retinal pigment epithelium[J]. Development, 2006, 133(20): 4109-4118.
[DOI]
|
| [7] |
Colley DG, Bustinduy AL, Secor WE, King CH. Human schistosomiasis[J]. Lancet, 2014, 383(9936): 2253-2264.
[DOI]
|
| [8] |
World Health Organization. Schistosomiasis: number of people treated worldwide in 2013 [R]. Wkly Epidemiol Rec, 2015, 90(5): 25-32.
|
| [9] |
Yang GJ, Ouyang HQ, Zhao ZY, Li WH, Fall IS, Djirmay AG, Zhou XN. Discrepancies in neglected tropical diseases burden estimates in China: comparative study of real-world data and Global Burden of Disease 2021 data (2004-2020)[J]. BMJ, 2025, 388: e080969.
[DOI]
|
| [10] |
Xie H, Chen D, Li L, Yu X, Wu C, Gu H, Tang X, Peng A, Huang J. Immune response of γδT cells in Schistosome japonicum-infected C57BL/6 mouse liver[J]. Parasite Immunol, 2014, 36(12): 658-667.
[DOI]
|
| [11] |
Rumbley CA, Zekavat SA, Sugaya H, Perrin PJ, Ramadan MA, Phillips SM. The schistosome granuloma: characterization of lymphocyte migration, activation, and cytokine production[J]. J Immunol, 1998, 161(8): 4129-4137.
[PubMed]
|
| [12] |
da Silva Filomeno CE, Costa-Silva M, Corrêa CL, Neves RH, Mandarim-de-Lacerda CA, Machado-Silva JR. The acute schistosomiasis mansoni ameliorates metabolic syndrome in the C57BL/6 mouse model[J]. Exp Parasitol, 2020, 212: 107889.
[DOI]
|
| [13] |
Hams E, Aviello G, Fallon PG. The schistosoma granuloma: friend or foe[J]. Front Immunol, 2013, 4: 89.
[DOI]
|
| [14] |
Cheever AW, Duvall RH, Hallack TA Jr. Differences in hepatic fibrosis and granuloma size in several strains of mice infected with Schistosoma japonicum[J]. Am J Trop Med Hyg, 1984, 33(4): 602-607.
|
| [15] |
Olds GR, Finegan C, Kresina TF. Dynamics of hepatic glycosaminoglycan accumulation in murine Schistosoma japonicum infection[J]. Gastroenterology, 1986, 91(6): 1335-1342.
[DOI]
|
| [16] |
Wei H, Xie H, Qu J, Xie A, Xie S, Huang H, Li J, Fang C, Shi F, Qiu H, Qi Y, Tian X, Yang Q, Huang J. TLR7 modulating B-cell immune responses in the spleen of C57BL/6 mice infected with Schistosoma japonicum[J]. PLoS Negl Trop Dis, 2021, 15(11): e0009943.
[DOI]
|
| [17] |
Dunlop MG, Dobbins SE, Farrington SM, Jones AM, Palles C, Whiffin N, Tenesa A, Spain S, Broderick P, Ooi LY, Domingo E, Smillie C, Henrion M, Frampton M, Martin L, Grimes G, Gorman M, Semple C, Ma YP, Barclay E, Prendergast J, Cazier JB, Olver B, Penegar S, Lubbe S, Chander I, Carvajal-Carmona LG, Ballereau S, Lloyd A, Vijayakrishnan J, Zgaga L, Rudan I, Theodoratou E, Colorectal Tumour Gene Identification (CORGI) Consortium, Starr JM, Deary I, Kirac I, Kovacević D, Aaltonen LA, Renkonen-Sinisalo L, Mecklin JP, Matsuda K, Nakamura Y, Okada Y, Gallinger S, Duggan DJ, Conti D, Newcomb P, Hopper J, Jenkins MA, Schumacher F, Casey G, Easton D, Shah M, Pharoah P, Lindblom A, Liu T, Swedish Low-Risk Colorectal Cancer Study Group, Smith CG, West H, Cheadle JP, COIN Collaborative Group, Midgley R, Kerr DJ, Campbell H, Tomlinson IP, Houlston RS. Common variation near CDKN1A, POLD3 and SHROOM2 influences colorectal cancer risk[J]. Nat Genet, 2012, 44(7): 770-776.
[DOI]
|
| [18] |
马义磊, 丛莉, 尹岚, 陈小平. 日本血吸虫感染进程中小鼠脾中专职性和非专职性抗原提呈细胞的动态变化[J]. 中国寄生虫学与寄生虫病杂志, 2013, 31(4): 298-302. |
 2024, Vol. 19
2024, Vol. 19


